会上报告了EORTC-GUCG 1333/PEACE-3临床试验的首批突破性成果,该研究首次在无症状或仅有轻度症状的骨转移性去势抵抗性前列腺癌患者群体中,对比了单独使用恩扎卢胺与镭-223联合恩扎卢胺治疗的疗效差异。(摘要号 LBA1)
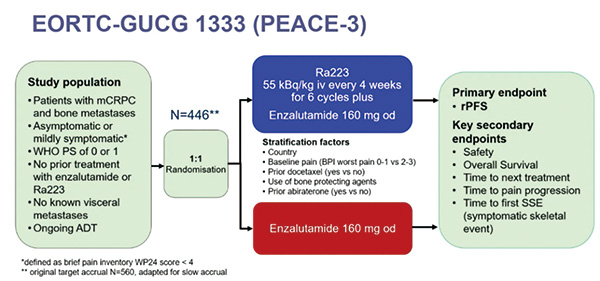
PEACE-3研究是一项由EORTC(欧洲癌症研究与治疗组织)/CTI(临床肿瘤学国际)/CUOG(泌尿妇科癌症研究组)/LACOG(拉丁美洲与加勒比海地区妇科肿瘤学组)/UNICANCER合作开展的Ⅲ期临床研究,旨在探究在mCRPC患者中对比恩扎卢胺与镭-223(ENZ-RAD)联合使用与单独使用恩扎卢胺(ENZ)的疗效和安全性。
该研究共纳入446例患有mCRPC和骨转移的男性患者,这些患者无症状或轻微症状,WHO PS为0或1,且既往未接受过恩扎卢胺或镭-223治疗。患者按照1∶1随机化双盲原则分配至两组,ENZ组(224例):恩扎卢胺 160 mg qd;ENZ-RAD组(218例):镭-223 55 kBq/kg 静脉注射每4周一次(共6个周期)+恩扎卢胺 160 mg qd。
截至2018年3月,所有患者均纳入唑来膦酸或地诺单抗的辅助治疗。研究的主要终点为rPFS。次要终点包括OS、后续系统性抗肿瘤治疗的时间(TTNT)、疼痛进展的时间(TTPP)和首发症状性骨相关事件时间(TTSSE)。
2015年11月至2023年3月,纳入的446例男性患者中位年龄为70岁(IQR:65~76岁),中位随访时间为42.2个月。在ENZ-RAD组中,有87.9%接受镭-223的患者成功完成了预定的6个治疗周期。研究结果显示,ENZ-RAD组的中位rPFS为19.4个月(95%CI 17.1~25.3个月),相比之下,仅接受ENZ治疗的对照组中位rPFS的16.4个月(95%CI 13.8~19.2个月),展现出显著获益。此外,rPFS的HR为0.69 (95%CI 0.54~0.87,P=0.0009),这意味着镭-223与恩扎卢胺联合治疗方案能有效降低31%患者疾病进展风险。
在达到80%总生存期事件时的期中分析中,ENZ组的中位OS为35.0个月(95%CI 28.8~38.9个月),而ENZ-RAD组则延长至42.3个月(95%CI 36.8~49.1个月),OS的HR为0.69(95%CI 0.52~0.90,P=0.0031),镭-223联合恩扎卢胺在OS方面具有统计学差异。
24个月时TTNT的对比分析显示,ENZ-RAD组和ENZ组的比例为51% vs 30%,镭-223联合恩扎卢胺显著改善了TTNT(HR=0.57,95%CI 0.44~0.75,P<0.0001)。
安全性评估显示,ENZ组和ENZ-RAD组中分别有96.4%和100%的患者报告了≥1级的治疗相关不良事件(TEAE),其中≥3级TEAE的发生率分别为55.8%和65.6%。在ENZ-RAD组中,最常见的≥3级TEAE是高血压(34%)、疲劳(6%)、贫血(5%)和中性粒细胞减少(5%)。尽管ENZ-RAD组中≥3级TEAE的发生率略高,但在各个不良事件中的增长幅度均未超过5%,这一数据表明联合疗法在增加严重不良事件风险方面仍保持着相对可控性与可接受性。
该研究提示,镭-223与恩扎卢胺的联合治疗方案与单独使用恩扎卢胺相比,显著延长患者的rPFS和OS,结果均具有统计学意义。不仅如此,该联合疗法在安全性和耐受性方面表现良好。基于以上研究数据,镭-223联合恩扎卢胺的治疗方案有望成为mCRPC患者一线治疗的新标准,为这一领域的临床实践带来革新性的变化。 (编译 张瑞轩)