FDA批准纳武利尤单抗辅助治疗ⅡB/ⅡC期黑色素瘤
10月13日,美国FDA批准纳武利尤单抗(Nivolumab,Opdivo)用于12岁及以上完全切除的ⅡB或ⅡC期黑色素瘤患者的辅助治疗。(自FDA)
该项随机双盲试验CheckMate 76K纳入了790例ⅡB/ⅡC期黑色素瘤患者,并评估了疗效。患者被按照2∶1的比例随机分配接受纳武利尤单抗480 mg或安慰剂,每4周静脉给药,持续1年或直到疾病复发或出现不可接受的毒性。
入组要求患者为随机分配前12周内切缘阴性和前哨淋巴结阴性的原发性黑色素瘤,并且ECOG PS评分为0或1。该试验排除了患有眼/葡萄膜或黏膜黑色素瘤、自身免疫性疾病、任何需要用皮质类固醇(每日≥10 mg泼尼松或同等药物)或其他免疫抑制药物进行系统治疗的患者,以及除手术外接受过任何黑色素瘤治疗的患者。按照美国癌症分期系统联合委员会第8版(T3b vs. T4a vs. T4b)进行分层。
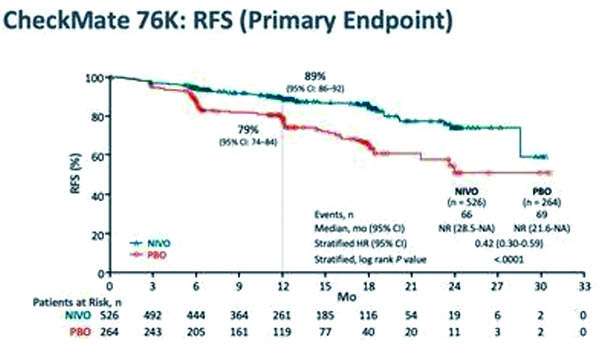
主要疗效指标是无复发生存期,定义为研究者评估的自开始随机分配时至首次复发(局部、区域或远处转移)、新发原发性黑色素瘤或任何原因导致的死亡之间的时间,哪个先发生都可以。在第1~3年每26周进行一次评估,此后5年每52周进行一次评估。纳武利尤单抗组(95%CI 28.5个月~未达到)和安慰剂组(95%CI 21.6个月~未达到;HR=0.42,95%CI 0.30~0.59,P=0.0001)的中位无复发生存期均未达到。
最常见(发生率≥20%)的不良反应是疲劳、肌肉骨骼疼痛、皮疹、腹泻和瘙痒。体重大于或等于40 kg的患者,纳武利尤单抗的推荐剂量为每2周240 mg或每4周480 mg,直至疾病进展或出现不可接受的毒性,持续1年。对于体重小于40 kg的儿科患者,推荐剂量为每2周3 mg/kg或每4周6 mg/kg,直至疾病进展或出现不可接受的毒性,持续1年。
(编译 郝春梅)