胰腺癌mRNA疫苗治疗研究突破
美国纪念斯隆·凯特琳癌症中心Rojas等报告,由基因泰克和BioNTech公司共同开发的mRNA个体化新抗原疫苗,在治疗胰腺癌的Ⅰ期临床研究中,表现出良好的安全性和出色的疗效,50%的患者对疫苗治疗产生应答,且mRNA疫苗与化疗和免疫治疗的序贯联用,使胰腺癌的复发和患者死亡风险,较未实现应答的患者降低92%。(Nature.2023;1-7.)
对5年生存率仅12%,连免疫检查点抑制剂也束手无策的癌中之王,能取得如此优异的疗效,着实值得关注。学界长期以来认为,免疫治疗对胰腺癌无效,一大原因就是胰腺癌的基因突变频率较低,可被T细胞识别的新抗原较少,再加之细胞外基质致密等因素,让胰腺癌成了缺少免疫细胞浸润的“免疫荒漠”。

美国纪念斯隆·凯特琳癌症中心研究者分析了少数罹患胰腺癌后长期生存的患者,发现胰腺癌的新抗原含量并不低,但只有少数符合特定条件的高质量新抗原才能充分激活T细胞,多数情况下,新抗原并未能被有效呈递给T细胞,免疫系统只能无能为力。
为患者注射含有新抗原的个体化癌症疫苗,可弥补这一缺失,解决免疫系统缺少新抗原刺激的问题。肿瘤异质性导致的不同患者新抗原差异,也可通过量身定制疫苗一并解决。mRNA疫苗技术的快速发展,尤其是新冠期间的迅猛发展,让快速制备疫苗成为现实。
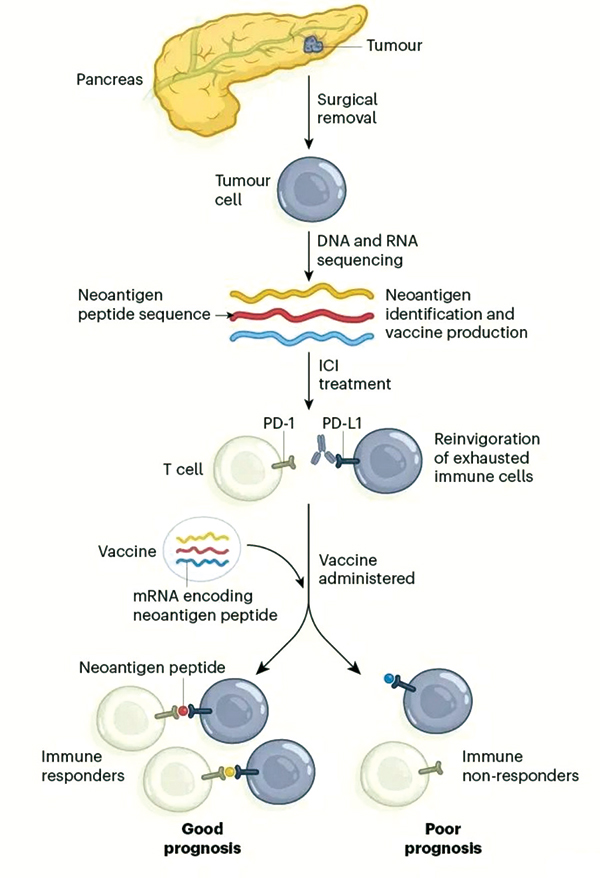
基因泰克、BioNTech两家公司的研发团队,与纪念斯隆·凯特琳癌症中心研究者协作,开展了这项早期临床研究,初步验证了mRNA个体化新抗原疫苗Autogene cevumeran的可行性和安全性。
具体流程:接受根治性手术切除的患者,术后先接受1剂PD-L1抑制剂阿替利珠单抗治疗,初步激活免疫应答。同时研究者们对肿瘤样本的DNA和RNA进行分析,筛选至多20个新抗原制备疫苗。此后,患者接受8剂Autogene cevumeran注射,再行12个周期mFOLFIRINOX方案辅助化疗,最后注射1剂加强针疫苗。
研究共入组34例患者,最终16例患者成功接受Autogene cevumeran治疗,15例按计划完成;疾病进展(7例)是导致患者退出研究的主要原因,也反映出胰腺癌的凶险,此外还有2例患者未能成功制备疫苗。
酶联免疫斑点分析(ELISpot)显示,8例患者在注射Autogene cevumeran后,存在特异性针对疫苗所含新抗原(至少对1个新抗原有应答,实际中位个数为2)的CD8+T细胞免疫应答,疫苗中约11%的新抗原是真正激活T细胞的高质量新抗原。

采用T细胞受体测序技术的进一步分析显示,被Autogene cevumeran激活的CD8+T细胞,并不与阿替利珠单抗激活的T细胞重叠,但足以高度特异性杀伤癌细胞,杀伤力不受研究中辅助化疗影响,能较长久存活。
不过,对抗击肿瘤同样重要的CD4+T细胞并未被Autogene cevumeran注射所激活,而另外8例患者未对疫苗产生应答,可能与肿瘤本身因素(肿瘤体积较大、突变多样性低)或手术切除患者脾脏(5例)有关。在小鼠身上开展的实验显示,切除脾脏会影响新抗原呈递和T细胞应答状态。
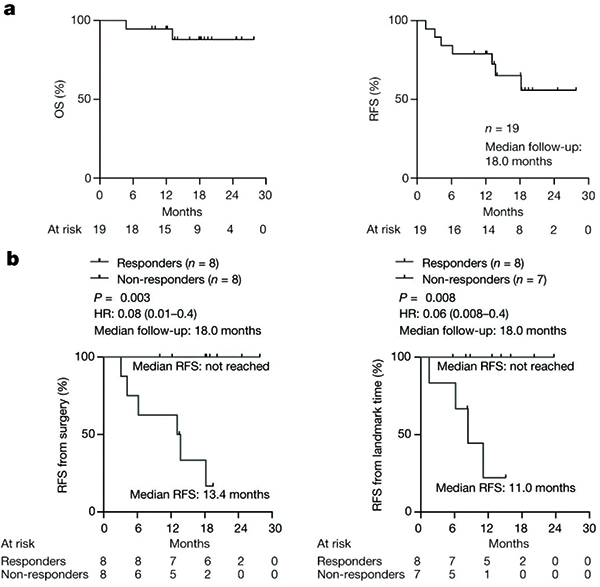
对Autogene cevumeran疫苗产生应答,也显著改善了患者的临床结局。中位随访18个月时的数据显示,未应答的8例患者中,6例出现肿瘤复发或死亡,中位无复发生存期为13.4个月;而有应答的8例患者仍生存,提示Autogene cevumeran使患者肿瘤复发或死亡的风险降低92%(HR=0.08)。
在安全性方面,Autogene cevumeran疫苗也表现良好,仅1例患者注射后出现3级不良事件(发热、高血压),3例患者因疾病进展、死亡或化疗毒性未能坚持注射完成全部疫苗;从患者手术结束到开始注射个体化疫苗,所需中位时间为9.4周。
研究者分析了1例在接受辅助化疗期间疑似出现肝转移(大小为7 mm,且病变处存在含有与原发灶相同TP53突变的罕见细胞)的患者,发现被Autogene cevumeran疫苗激活和扩增的CD8+T细胞成功清除了此处病变,提示个体化疫苗可助力胰腺癌患者清除微转移灶,这对改善患者的长期预后极为重要。
虽然该研究作为一项样本量有限的临床Ⅰ期研究,研究结果还不能充分证实mRNA个体化新抗原疫苗的疗效,但研究数据足以支持后续的全球性、多中心临床研究开展。研究者表示,近几年mRNA疫苗技术的飞跃式发展,意味着后续临床研究将使用制备更快、更为精准的疫苗,新疫苗的表现也许会更优异。
(编译 张楠)














