研究揭示乳酸在肿瘤发生中的作用
苏州大学周芳芳教授等发现,乳酸能促进p53蛋白的乳酸化,导致p53蛋白活性异常,阻碍了细胞周期的调节过程从而促进肿瘤发展。(Cell. 2024, 187: 2375-2392.e33)
p53是经典的抑癌蛋白,许多癌症类型中都能检测到p53突变,或明显的p53活性下调,而乳酸的调节机制就属于后者。研究者在分析TCGA乳腺癌数据集时发现,一些患者本身拥有着正常的p53蛋白,但如果其基因特征对应着高乳酸水平的话,患者的p53信号通路会维持在相对更低的水平,这也说明乳酸越多,p53功能受损越严重。小鼠实验中,研究者尝试给小鼠注射了乳酸钠,结果小鼠的p53活性也明显受到抑制。
研究者观察到p53活性的抑制往往伴随着p53乳酸化而发生,这说明癌细胞中过多累积的乳酸会渐渐关闭原本的抑癌蛋白活性,促成肿瘤更疯狂的生长过程。
正常细胞呼吸代谢是获得能量的主要优先来源,而癌细胞即使在氧气充足的情况下,也喜欢借助糖酵解而不是呼吸作用获取能量,这让癌细胞对葡萄糖的消耗很大,也会产生大量代谢产物乳酸,癌细胞似乎非常喜欢乳酸造就的酸性环境。既往有研究发现,乳酸可诱导DNA损伤修复蛋白乳酸化,导致化疗耐药性发生,乳酸还能引起癌症患者发生恶液质,导致患者产生极度消瘦、衰竭等严重病症。
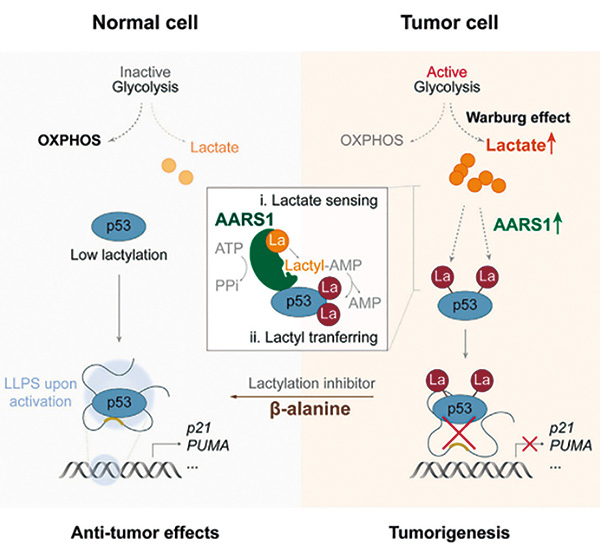
为了探索哪些因素促进了p53的乳酸化,研究者对肿瘤细胞进行了全面的基因分析。借助CRISPR技术筛选手段,研究者发现负责编码丙氨酰-tRNA合成酶1(AARS1)的基因在p53乳酸化过程中必不可少,当敲除掉这个基因后,会重新提升p53的反应活性,解除原本的抑制现象。丢失了AARS1的肿瘤细胞,即使有乳酸钠的供应也失去了往日的威风,其生长速度减缓、克隆形成能力下降,肿瘤移植体也难以发展。
研究者发现,AARS1就像一个“乳酸传感器”,它能敏锐地检测游离的乳酸并与之结合,在ATP依赖条件下形成乳酸-AMP,然后将乳酸转移到赖氨酸残基上,构成赖氨酸乳酸基。AARS1的介导过程有很多靶点,对癌细胞来说,p53就是其中的靶点之一,p53的DNA结合域上的两个赖氨酸会被乳酸化,导致p53无法与应答元件,比如p53RE-DNA结合,最终导致活性下降。
这些发现不仅再次证实了乳酸在癌症发展中的重要作用,也为癌症治疗带来了新的思路,比如研究发现b-丙氨酸可竞争性地与AARS1结合,阻止p53乳酸化的发生,这或许可与其他癌症疗法联用,增强肿瘤清除的效果。
(编译 张嘉佳)


