A-BRAVE研究结果会上公布 Avelumab辅助治疗改善高危三阴性乳腺癌患者总生存
会上,A-BRAVE研究结果进行了报告,该研究旨在评估Avelumab用于新辅助化疗后有残留病变、或初次手术和辅助化疗后处于高风险的早期三阴性乳腺癌(TNBC)患者辅助治疗的有效性。研究结果显示,与对照组相比,Avelumab治疗虽然并未显著改善高风险TNBC患者的DFS,但却显著改善了OS(包括总人群和新辅助化疗后有侵袭性残留病灶人群),使总体人群死亡风险降低34%,提示辅助免疫疗法可使初治术后的高危患者获益。(摘要号LBA500)
这项Ⅲ期、多中心研究于2016年6月至2020年10月在意大利和英国共70个医学中心进行,共纳入477例既往接受过手术和新辅助/辅助化疗的高风险早期TNBC患者,其中高风险定义为:1)新辅助化疗后有侵袭性残留病灶(乳腺和/或淋巴结,A层分层),2)初次手术和辅助化疗后存在>pN2/任何pT、pN1/pT2或pN0/pT3疾病(B层分层)。
患者按1∶1比例(A、B两层患者比较均衡)随机分配接受辅助Avelumab(10 mg/kg,每两周一次)静脉注射治疗(试验组)或观察1年(观察组)。共同主要终点为总人群和A层人群的无病生存期(DFS)。关键次要终点为总生存期(OS)。
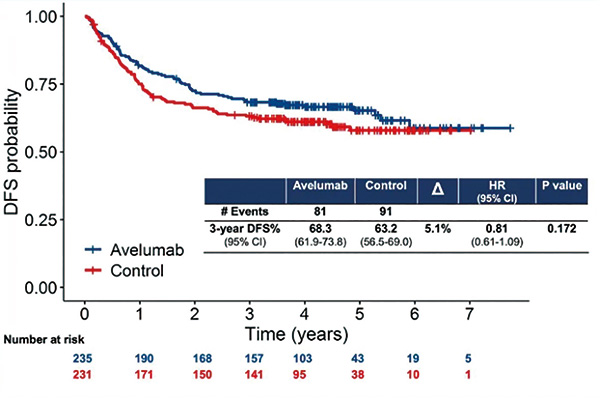
研究结果显示,总人群的3年DFS率仅提高了5.1%,即从观察组的63.2%提高到试验组的68.3%(HR=0.81,95%CI 0.61~1.09,P=0.172)。在新辅助化疗后有侵袭性残留病灶人群中,结果略有改善(提高了6.2%),但仍未达到统计学意义:3年DFS率从观察组的60.7%提高到试验组的66.9%(HR=0.80,95%CI 0.58~1.10,P=0.170)。
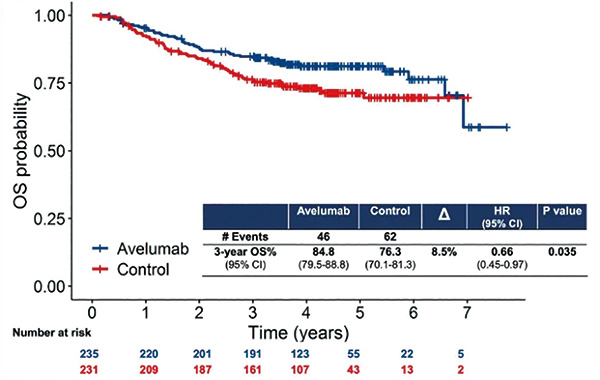
而与观察组相比,试验组将总人群的3年OS率提高了8.5%(84.8% vs. 76.3%;HR=0.66,95%CI 0.45~0.97,P=0.035),死亡风险相对降低34%(HR=0.66,95%CI 0.45~0.97,P=0.035);此外,与观察组相比,试验组将新辅助化疗后有侵袭性残留病灶人群的3年OS率提高了8.6%(82.7% vs. 74.1%),死亡风险相对下降31%(HR=0.69,95%CI 0.46~1.03,P=0.070)。
研究者表示,DFS和OS结果之间存在差异的原因尚不清楚,但这可能部分是由于DFS终点中包含的事件类型所导致的。目前,研究者正在进一步分析数据,以解释试验组OS获益的原因。此外,与观察组相比,试验组的远端疾病事件发生更少(48件 vs. 58件),同时在记录的DFS发生之前死亡人数也更少(1例 vs. 4例)。
Avelumab疗法具有良好的耐受性,72%的患者完成了1年的治疗,其中极少数患者(1.3%)出现≥3级免疫相关不良事件。最常见的免疫相关不良事件包括甲状腺功能减退、结肠炎/腹泻、甲状腺功能亢进和转氨酶升高。
总的来说,与观察组相比,Avelumab治疗虽然并未显著改善高风险TNBC患者的DFS,但却显著改善了OS。
研究者指出,A-BRAVE试验是首个报告免疫检查点抑制剂—Avelumab—用于新辅助化疗后出现侵袭性残留疾病的(TNBC)患者的试验。这项试验允许我们将通过新辅助化疗达到病理学完全缓解(pCR)的患者从免受免疫检查点抑制剂的毒副作用中排除,因为这些患者在没有任何进一步治疗的情况下预后极佳。
研究者表示,目前的一个关键问题是,如何在临床实践中将A-BRAVE试验结果与其他治疗方案相结合。因为在这项试验启动不久后,Ⅲ期KEYNOTE-522试验就改写了标准治疗(新辅助帕博利珠单抗+化疗用于cT1c和/或cN+ TNBC患者的标准治疗)。而这项研究的设计尚未考虑这一临床实践变化。不过KEYNOTE-522试验尚未显示出围手术期联合使用帕博利珠单抗后可以显著改善OS,而这项试验证实了辅助Avelumab方案的OS获益。
研究者指出,OS虽然是一个次要终点,但在一个选择性强的患者群体中OS显著延长且不良反应小。这些数据可能挑战目前的标准,并可能为所有因任何原因接受过新辅助化疗(未联合使用帕博利珠单抗)且在手术中存在侵袭性残留病灶的患者提供一种选择。
(编译 张嘉佳)














