Watson S1, Validire P, Cervera P, Zorkani N, Scriva A, Lemay F, Tournigand C,
Perniceni T, Garcia ML, Bennamoun M, Paye F, Louvet C.
Ann Oncol. 2013 Dec;24(12):3035-9. doi: 10.1093/annonc/mdt393. Epub 2013 Oct
10.
背景:HER2在胃食管腺癌中的表达率为10-20%,是晚期肿瘤患者曲妥珠单抗的治疗靶点。本研究旨在胃食管腺癌中比较诊断性活检标本和手术标本的HER2表达情况,以及不含曲妥珠单抗的新辅助化疗对HER2表达的影响。
患者与方法:本研究收集了2004-2011年间接受手术的228例患者的活检标本。根据患者是否接受新辅助化疗分为2组(新辅化组141例,非新辅化组87例)。运用免疫组化(IHC)和显色原位杂交(CISH)方法检测活检标本与手术标本的HER2表达水平。根据胃食管腺癌专用的HER2评分标准,HER2阳性(HER2+)定义为IHC
3+或IHC 2+同时CISH阳性。
结果:228例患者中共有218例患者(95.6%)的配对标本可明确HER2表达。活检标本的HER2阳性率是13.2%(29/218),手术标本的HER2阳性率是14.7%(32/218)。HER2阳性的肿瘤多为贲门或食管腺癌、高分化、肠型。6%的病例活检和手术标本HER2表达不一致。综合分析活检标本和手术标本的HER2结果,HER2阳性率相对增加了13.5%(新辅化组相对增加率为17.1%,其中对新辅助化疗有组织学反应的患者相对增加率为23.5%,而非新辅化组只相对增加了7.1%,P=0.4)。活检和手术标本HER2表达的差异可能原因是,肿瘤内异质性,以及手术标本在新辅助化疗有效的肿瘤中HER2表达的下降,因为HER2阳性的肿瘤化疗敏感性更高。
结论:对活检标本行HER2检测有助于完善手术标本的检测结果。若发生复发转移,对活检和手术标本的综合分析能够优化对曲妥珠单抗受益人群的选择,尤其是既往曾行新辅助化疗的病人。
关键词:HER2,胃癌,新辅助化疗
引言
胃-食管腺癌(GE-ADK)是第二大常见消化道肿瘤
[1],手术是可切除肿瘤的唯一根治手段。2006年的MAGIC试验表明,围手术期化疗可提高胃食管腺癌的5年生存期
[2]。此后,多个试验均证实了围手术期化疗的优势 [3-5]。目前,5-FU联合铂类是局限性胃食管腺癌的标准围手术期化疗方案。
HER2在胃食管腺癌中的表达率为10-20% [6],对预后的影响仍有争议
[7-8]。可通过免疫组化(IHC)和原位杂交技术(FISH或CISH)检测胃食管腺癌原发灶和转移灶标本以明确HER2的表达状态。HER2阳性(HER2+)定义为IHC
3+或IHC 2+同时ISH扩增阳性
[9]。ToGA研究显示,在HER2阳性的转移性胃食管腺癌中,与单独化疗相比,曲妥珠单抗联合5-FU和铂类可明显改善患者的OS和PFS
[10],已成为HER2阳性的转移性胃食管腺癌的标准治疗方案。目前,仅少部分研究关注胃食管腺癌活检标本和手术标本HER2表达的一致性,也尚无新辅助化疗对手术标本HER2表达影响的相关报道。
本研究旨在阐明如何更好地筛选曲妥珠单抗受益人群。我们比较了228例胃食管腺癌患者的活检标本和手术标本的HER2表达水平,并评估不含曲妥珠单抗的新辅助化疗是否影响手术标本中HER2表达状态。
患者与方法
研究人群、治疗策略和试验设计
患者入选标准:
(i)组织病理学证实为胃腺癌或食管-胃腺癌(下段食管和贲门);
(ii)2004-1-1至2011-12-31期间在Institute Mutualiste
Montsouris或Saint-Antoine医院接受根治性手术;
患者排除标准:未收集到治疗前的活检标本,或活检标本组织过少、不能作出确定诊断。
患者被分为两组:新辅助化疗组患者术前接受5-FU和铂类为基础的化疗,非新辅助化疗组术前未接受化疗。
所有患者均被书面告知本研究的目的并获得其知情同意。临床和病理学数据统一管理,专人负责。该研究方案符合国际要求,得到机构审查委员会的审核批准。
病理标本收集
保存石蜡包埋活检标本的病理中心提供每例患者的肿瘤组织标本。石蜡包埋的手术标本自手术之日起一直保存在以上两个研究中心。配对的标本(包括活检标本和一块石蜡包埋的手术标本)被匿名储存且可通过组织编号和研究编号来查找。
病理学分析
所有配对的组织标本均进行了免疫组化检测。按照说明书,运用HER2抗体(clone 4B5)在全自动免疫组化染色仪(Benchmark XT
Ventana)上检测HER2的表达。根据胃食管腺癌的评分标准来判定HER2的表达状态。
若活检标本和/或手术标本的IHC评分为2+,则进一步运用CISH方法(BenchMark XT, Ventana HER2 dual-color ISH
assay)检测HER2扩增情况。HER2/CEP17≥2者定义为HER2扩增阳性。所有IHC和CISH结果均由两位病理学家单独判读,若两位病理学家判读结果不一致,则由第三位病理学家判读进而达成一致。HER2阳性(HER2+)定义为IHC
3+或IHC 2+同时CISH扩增阳性。
根据胃食管腺癌的通用指南对新辅助治疗后手术标本的组织学反应进行评价。
结果
患者特征
筛选的278例患者中,39例患者因活检标本不可用退出研究,11例患者因组织标本量不足退出研究,因此,一共收集了228例患者的配对标本。所有标本均运用IHC检测了HER2表达情况,IHC
2+者进一步行CISH检测。其中10例标本因技术原因或标本中肿瘤细胞含量太低无法分析,最终共有218例配对标本可供分析。
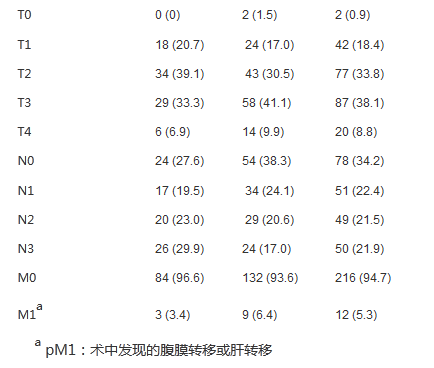
表1总结了入组患者的临床病理特征。由于围手术期化疗的获益在2006年被证实 [2],未接受新辅助化疗患者的手术日期大多早于新辅助化疗患者。
表1.患者基线特征

肿瘤临床病理学特征
本研究分析的218例患者中,几乎一半患者的肿瘤发生于食管-胃结合部(贲门和/或下段食管)。与HER2阴性(HER2-)肿瘤相比,HER2阳性(HER2+)肿瘤更好发于近端胃(P=0.02)(表2)。
表2. HER2表达状态与临床病理特征的关系
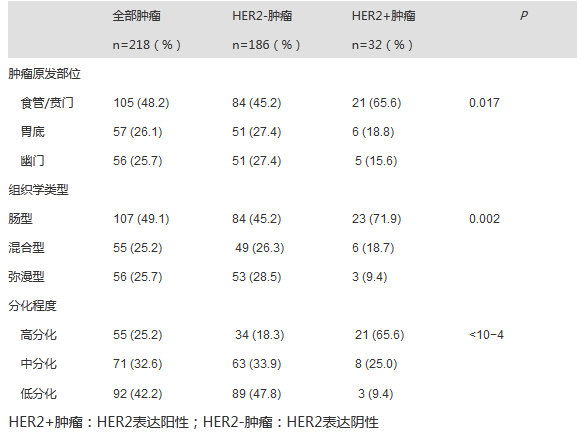
肠型肿瘤几乎占据所有肿瘤的一半,而且在HER2阳性肿瘤中的比例明显高于HER2阴性肿瘤(P=0.002)。所有患者中,低分化肿瘤占大多数,但大部分HER2+肿瘤发生在高分化肿瘤中(P<10-4)。
活检标本和手术标本的HER2表达分析
所有标本均进行了免疫组化检测(补充图1)。在228例活检标本中,163例标本(71.5%)评分为0/1+,63例标本(27.6%)评分为2+/3+,2例标本(0.9%)无法分析。在228例手术标本中,163例标本(71.5%)评分为0/1+,62例标本(27.2%)评分为2+/3+,3例标本(1.3%)无法分析。虽然在活检标本和手术标本两组中,HER2评分0/1+和2+/3+两组比例极其相似,但37例(17%)配对标本的IHC评分不一致(活检标本评分为0/1+者在手术标本则评分为2+/3+,或活检标本评分为2+/3+者在手术标本则评分为0/1+)。
活检标本或手术标本IHC评分为2+的59例配对标本进一步进行CISH检测(补充图2),其中,38例活检标本为IHC
2+(其余21例为0/1+,但相应的手术标本为2+),39例手术标本为IHC
2+(其余20例为0/1+,但相应的活检标本为2+)。活检标本中共检出5例(8.9%)标本HER2扩增,手术标本中共检出10例(17%)标本HER2扩增。在38例IHC为2+的活检标本中,仅有4例(10%)标本CISH结果为HER2扩增。在39例IHC为2+的手术标本中,9例(23.1%)标本CISH结果为HER2扩增。
两位病理学家判读IHC和CISH结果的一致率分别达到99.1%和87.3%(补充表S1)。
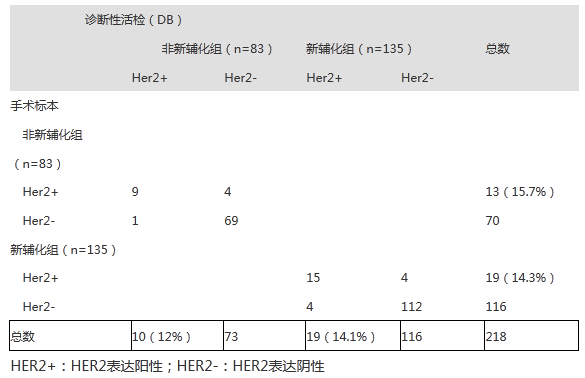
最终,218例可分析的配对标本中,29例(13.3%)活检标本为Her2+,32例(14.7%)手术标本为Her2+。在83例未接受新辅助化疗的患者中,10例(12%)活检标本HER2+,13例(15.7%)手术标本HER2+。在135例接受新辅助化疗的患者中,19例(14.1%)活检标本HER2+,19例(14.1%)手术标本HER2+。HER2+的活检和手术标本可能来源于不同患者(表3)。
表3. 两组患者活检和手术标本HER2表达的一致性
配对活检和手术标本中HER2表达的一致性
在218例配对标本中,活检和手术标本的总一致率为94%(205/218),这一比例在两组中是相似的。在非新辅化组,5例配对标本中HER2表达不一致,其中4例为活检标本HER2-而手术标本HER2+(转阳),只有1例为活检标本HER2+而手术标本HER2-(转阴)。
在新辅化组,8例配对标本中HER2表达不一致,其中4例转阳和4例转阴。在4例转阴标本中,3例表现出明显的组织学反应,1例表现出轻微的组织学反应。4例转阳标本均未表现出组织学反应。4例手术标本由于IHC失败(n=2)或CISH失败(n=2)未能检测出HER2表达状态,均表现出明显的组织学反应。
综合分析活检和手术标本
在所有患者中,将活检和手术标本进行综合分析,HER2阳性率由14.7%(只根据手术标本确定的HER2状态)升高至17%(图1A)。这意味着,HER2阳性的比例相对增加了13.5%(图1B)。在非新辅化组中,活检和手术标本综合分析仅使HER2阳性率由15.7%略增加至16.9%,相对增加了7.1%。在新辅化组中,活检和手术标本综合分析使有明显组织学反应的病例HER2阳性率相对增加了23.5%(图1B),但在无明显组织学反应的病例中却无明显增加。
讨论
本研究纳入了228例胃食管腺癌的配对标本,评价了活检和手术标本HER2表达状态的一致性。之前关于胃食管腺癌HER2的研究主要是关注IHC和ISH检测技术的一致性
[13,14],或者是原发灶和转移灶HER2表达的一致性[15-17]。只有少数研究评价了活检和手术标本HER2表达的一致性,尚无新辅助化疗对HER2表达影响的相关研究[8,18-22]。
在本研究中,手术标本的HER2阳性率为14.7%,在活检和手术标本中的一致性为94%,与其他研究报道一致(74.1%-92.9%)(补充表S2)。
新辅化组和非新辅化组患者配对标本的HER2表达一致性与上述类似,但非新辅化组中手术标本HER2转阳的比例更大,而新辅化组转阴和转阳比例相似。此外,活检和手术标本的综合分析使新辅化组的HER2+相对增加率为17.4%,使有组织学反应的标本阳性率相对增加23.5%,相反,在非新辅化组综合分析仅有7.1%的HER2+相对增加率,有组织学反应的标本阳性率增加0%。
20%-70%的HER2+胃食管腺癌存在肿瘤内异质性,这也是活检和手术标本存在不一致性的主要原因。我们发现手术标本的HER2表达状态受新辅助化疗影响,因而仅把手术标本作为HER2诊断的依据可能剥夺了相当一部分患者治疗获益的机会。对新辅助化疗有效的患者来说,手术标本的HER2分析是不可靠的,可能原因有检测技术失败率高、HER2转阴率高、残留肿瘤细胞少。HER2+肿瘤相对于HER2-的肿瘤有更高的化疗敏感性,这可能导致病理学有效的肿瘤在新辅助化疗后HER2的检测失败。
本研究表明,在明确HER2表达状态时,需要考虑到肿瘤内异质性和对新辅助化疗的反应。胃肠病学家在为患者行初次胃镜检查时应尽量获得足够多的标本。对于未行新辅助化疗的局限期肿瘤,检测手术标本的HER2状态依然是金标准,而对已行新辅助化疗的患者,HER2表达状态需要根据最初的活检标本来明确,如果为阴性,则应再次评价手术标本。如此则可以优化肿瘤组织HER2的检测,更好地筛选出能从曲妥珠单抗治疗中获益的人群。