研究发现血小板因子4或为新抗肿瘤因子
日本大阪大学Kuratani等发现,在肿瘤酸性微环境的刺激下,肿瘤里的巨噬细胞会释放血小板因子4(PF4),作用于肿瘤中的调节性T细胞(Treg),促使Treg往辅助性T细胞1(TH1)型细胞亚群极化,形成免疫抑制能力更强的TH1-Treg细胞,帮助肿瘤实现免疫逃逸。靶向PF4的抗体,可降低肿瘤微环境中TH1-Treg细胞数量,增强抗肿瘤免疫力,并抑制肿瘤生长。(Science. 2024年11月22日在线版)
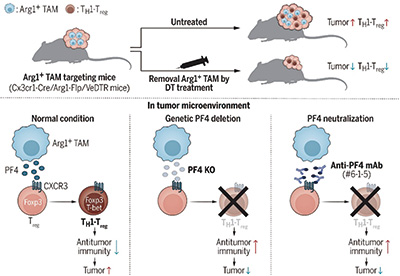
已有研究发现,肿瘤相关巨噬细胞(TAM)与肿瘤内调节性T细胞(Treg)存在密切关系。清除肿瘤中巨噬细胞,可降低瘤内Treg细胞水平。瘤内Treg细胞可进一步极化为辅助性T细胞1(TH1)型亚群——TH1-Treg细胞。
TH1-Treg细胞不仅表达Treg细胞标志物Foxp3,还表达TH1亚型特异性转录因子T-bet,还在肿瘤中大量聚集,有强大的免疫抑制能力。不过学界并不清楚肿瘤相关巨噬细胞与TH1-Treg细胞在肿瘤中的增加是否有关。
研究者构建了一个特异性清除TAM的遗传系统,并在这个系统的基础上探索TAM与TH1-Treg细胞之间的关系。为特异性清除TAM,研究者选择了两个标志物,一个是TAM特异性高表达的精氨酸酶1(Arg1),另一个是巨噬细胞和单核细胞标志物Cx3cr1(防止伤害到其他表达Arg1的细胞),随后构建了可以特异性清除TAM的VeDTR小鼠模型。通过小鼠模型实验研究者发现,Arg1阳性TAM主要聚集在肿瘤的缺氧区,而且特异性清除Arg1阳性TAM可以抑制肿瘤的生长。
分析瘤内免疫细胞类型发现,清除Arg1阳性TAM可降低肿瘤中TH1-Treg细胞和免疫抑制性TAM比例;免疫刺激CD11b阳性细胞和T-bet+LAG-3-CD8+T细胞比例增加。清除Arg1阳性TAM,不仅减少瘤内免疫抑制性细胞,还增加抗癌免疫细胞水平,提高抗肿瘤免疫力。
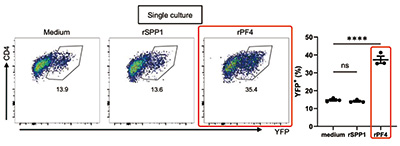
将Arg1阳性TAM与Treg细胞共培养,发现确实可以促进TH1-Treg细胞的形成,是Arg1阳性TAM的分泌物发挥了作用。对转录组数据的分析发现,是分泌蛋白血小板因子4(PF4;又称Cxcl4)。重组PF4蛋白处理实验也证实,PF4就是特异性参与Arg1阳性TAM诱导的TH1-Treg细胞极化的细胞因子。在比较不同组织巨噬细胞的PF4 mRNA表达水平时,Arg1阳性TAM的水平最高。
Arg1阳性TAM分泌PF4促进TH1-Treg细胞极化的分子机制的探讨发现:在进行有氧糖酵解的肿瘤中,含有大量的乳酸,乳酸会促进Arg1阳性TAM分泌PF4;随后,PF4会与Treg细胞表面的受体CXCR3结合,促进TH1-Treg细胞的形成。
Treg细胞表达CXCR3依赖于IFN-γ,IFN-γ信号诱导的CXCR3表达是TH1-Treg细胞极化的先决条件,而PF4则进一步加强了这种极化。IFN-γ是一种主要由T细胞和NK细胞等产生的促炎细胞因子,也是T细胞被激活的标志之一。这里IFN-γ竟然成了免疫抑制细胞TH1-Treg形成的先决条件,提示T细胞的浸润和激活,会促进肿瘤发动各方力量加强免疫抑制。
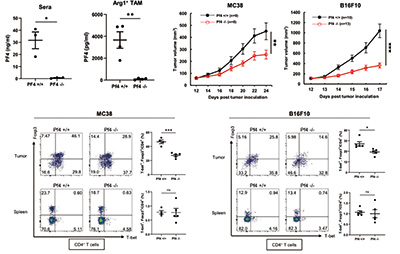
研究者发现,敲除PF4编码基因,可抑制肠癌(MC38)和黑色素瘤(B16F10)小鼠模型的肿瘤生长,且小鼠肿瘤中的TH1-Treg细胞比例显著下降。特异性敲除Arg1阳性TAM的PF4编码基因即有抗肿瘤效果,提示巨噬细胞分泌的PF4在促进TH1-Treg细胞形成和肿瘤生长方面发挥重要作用。
研究者开发了特异性靶向PF4的抗体(#6-1-5),基于肠癌小鼠模型的实验发现,抗PF4抗体(#6-1-5)的抗肿瘤疗效或与抗CTLA4抗体相当。抗PF4抗体不改变肿瘤内的血管结构,也不导致体重下降或免疫细胞异常活化。提示依赖于PF4中和的TH1-Treg细胞耗竭,或比完全耗竭Treg细胞更安全。
基于人类癌症基因组图谱(TCGA)数据库的分析显示,PF4水平高的肿瘤患者生存率显著低于PF4水平低患者。在PF4水平较高的肿瘤患者中,CD11b表达水平高患者的生存率低于CD11b低患者,提示PF4阳性TAM的数量越多,患者的预后越差。
该研究证实,Arg1阳性TAM直接参与TH1-Treg细胞形成,研究对潜在机制进行了探讨,对为何清除TAM会降低瘤内Treg细胞,并能抑制肿瘤生长进行了深入研究。研究结果为定向清除瘤内肿瘤相关巨噬细胞和Treg细胞的肿瘤免疫疗法,指出了新研发方向。 (编译 张俊熙)
