FDA批准复发难治急性髓性白血病第一种靶向药物
发布时间:2018-08-06
点击量:
美国FDA日前批准Ivosidenib(Tibsovo)用于治疗有特定基因突变的复发难治性急性髓性白血病患者,这是第一种获批的IDH1抑制剂,FDA同时批准IDH1基因突变检测试剂盒。(自FDA)
Ivosidenib有望满足有IDH1突变复发难治急性髓性白血病的治疗需求,该药物治疗可为有些患者带来完全缓解,减少红细胞和血小板成分输血。Ivosidenib是异柠檬酸脱氢酶-1(IDH1)抑制剂,可减少2-羟基戊二酸致癌代谢物的生成,促使恶性急性髓性白血病细胞的分化。

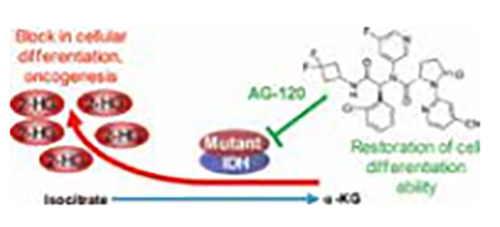
若患者血中或骨髓标本用FDA批准的伴随实时检测试剂盒检测到IDH1突变,患者即可接受Ivosidenib治疗。
Ivosidenib的疗效在单臂研究174例复发或难治急性髓性白血病患者中得到了验证,328%的患者获得完全缓解或血液学部分恢复的完全缓解(CR+CRh)中位持续8.2个月。110例试验开始时需要接受输血或血小板的患者中,37%的患者Ivosidenib治疗后至少56天不需输血。
Ivosidenib最常见的不良反应包括疲劳、血白细胞增多、关节痛、腹泻、气促、上肢或下肢肿胀、恶心、口腔或喉咙疼痛或溃疡、心律不齐(QT间期延长)、皮疹、发热、咳嗽和便秘等。哺乳期女性禁用Ivosidenib,因其可能对新生儿带来害处。该药物有针对分化综合征的黑框警告以及QT间期延长和Guillain-Barré综合征的警告,患者治疗期间需进行相关监测和应对。
Ivosidenib获得FDA的快速审批通道和优先审批以及孤儿药资格。
(编译 张志乾)
上一篇:
小剂量电离辐射也增加AML和ALL风险














