Ibrutinib联合Obinutuzumab一线治疗CLL/SLL
美国生物技术巨头艾伯维(AbbVie)近日宣布,美国FDA已受理其靶向抗癌药Imbruvica(Ibrutinib,依鲁替尼)的一份补充新药申请(sNDA),并授予了优先审查资格。该sNDA寻求批准Imbruvica联合罗氏抗癌药Obinutuzumab(Gazyva,奥妥珠单抗)用于既往未接受治疗的(初治)慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)成人患者的治疗。(自FDA)
若该sNDA获批,Ibrutinib与Obinutuzumab联合用药方案将成为FDA批准CLL/SLL一线治疗的首个无化疗(chemotherapy-free)抗CD20组合方案。目前,Ibrutinib获FDA批准作为单药疗法以及与苯达莫司汀和利妥昔单抗(BR)组合用于CLL/SLL的治疗。
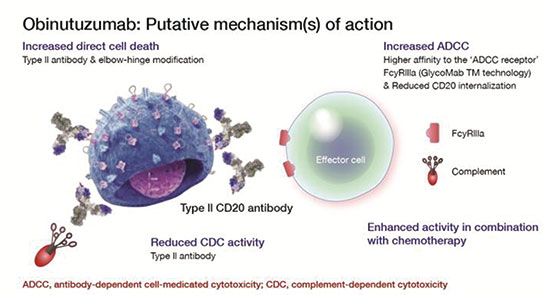
此次sNDA的提交,是基于Ⅲ期临床研究iLLUMINATE(PCYC-1130)的数据。该研究是一项随机、多中心、开放标签研究,在初治CLL/SLL成人患者中开展,评估了Ibrutinib联合Obinutuzumab方案相对于美国国家综合癌症网络(NCCN)指南1类治疗方案(即苯丁酸氮芥+Obinutuzumab化疗免疫疗法)的疗效和安全性。
研究数据显示,与苯丁酸氮芥+Obinutuzumab方案相比,Ibrutinib+Obinutuzumab方案显著延长了无进展生存期(PFS),达到了研究的主要终点。
目前CLL/SLL治疗仍局限于化疗,一旦疾病复发,这类患者的总生存期通常仅为2~3年,这一疾病领域还有巨大的医疗需求亟待满足。
Ibrutinib是一种每日口服一次的首创BTK抑制剂,BTK是B细胞受体信号复合物中的关键信号分子,在恶性B细胞的存活和转移以及其他多种疾病中发挥重要作用。Ibrutinib能阻断介导B细胞不受控制地增殖和扩散的信号通路,帮助杀死并降低癌细胞数量,延缓疾病恶化。在临床试验中,Ibrutinib单药及组合疗法针对广泛类型的血液系统恶性肿瘤显示出了强大的疗效。
在美国,FDA已授予Ibrutinib多达4个突破性药物资格。截至目前,Ibrutinib已获FDA批准治疗5种B细胞血液癌症以及包括慢性移植物抗宿主病(cGVHD)在内总共6种疾病领域多达9种治疗适应证,包括:既往已接受治疗一种疗法的套细胞淋巴瘤(MCL)成人患者;既往已接受至少一种疗法的CLL成人患者;携带17p缺失突变的CLL成人患者;一线治疗CLL;治疗Waldenstrom巨球蛋白血症(WM);联合苯达莫司汀+利妥昔单抗(BR)治疗CLL/SLL成人患者;治疗需要系统疗法且至少接受过一种抗CD20疗法的边缘区淋巴瘤(MZL)成人患者;对一种或多种系统疗法治疗失败的慢性移植物抗宿主病(cGVHD)成人患者;联合利妥昔单抗治疗Waldenstrom巨球蛋白血症(WM)成人患者。
(编译 王娜)














