研究发现肿瘤代谢检查点抑制剂
美国约翰斯·霍普金斯大学Powell等发明了一种神奇的小分子,可以消除肿瘤的免疫抑制性,还可提升T细胞抗肿瘤效果。研究者发现阻断谷氨酰胺代谢的小分子化合物JHU083可扰乱肿瘤的代谢,让肿瘤的瓦博格效应瘫痪,逆转肿瘤微环境的缺氧、多酸和缺营养状态,解除肿瘤微环境的免疫抑制能力。(Science. 2019年11月7日在线版 doi: 10.1126/science.aav2588)

研究者发现,这一小分子化合物还可重编程T细胞的代谢方式,直接激活T细胞,让T细胞寿命更长,促进记忆T细胞形成,提示JHU083具有破坏肿瘤微环境和激活免疫系统的功能,既能解除肿瘤对免疫检查点抑制剂的耐药性,又能激活T细胞杀灭肿瘤细胞。研究者将这一疗法命名为代谢检查点抑制剂。
肿瘤微环境低氧、多酸和缺乏营养,为肿瘤细胞提供了保护伞,可谓免疫细胞的不毛之地。免疫治疗对多数患者无效,肿瘤微环境难辞其咎。肿瘤微环境的形成有赖于肿瘤特殊的代谢方式,即瓦博格效应,正是肿瘤的这种特殊的代谢方式,成就了促进肿瘤生长且抑制免疫系统的肿瘤微环境。
肿瘤组织中葡萄糖是通过糖酵解的方式代谢成乳酸,谷氨酰胺可促进三羧酸循环,生成代谢中间体,用以合成脂质、蛋白质和核酸等对细胞生长增殖至关重要的物质。学界推测,阻断谷氨酰胺代谢或可抑制肿瘤生长,甚至能解除肿瘤对免疫系统的抑制。无奈阻断谷氨酰胺代谢有关的酶的尝试效果不理想,针对多种代谢有关酶的化合物DON毒性又达到难以接受。
研究者对DON进行了一些改造,使其成为一种前药,需要进入肿瘤微环境,经过特殊的酶处理,才能变回DON,降低了谷氨酰胺代谢途径抑制剂的毒性,于是就有了JHU083。
为了验证JHU083的抗肿瘤效果,研究者在结直肠癌MC38、淋巴瘤EL-4、结肠癌CT26、黑色素瘤B16四个细胞系中进行了深入研究,接种四种细胞到小鼠后,注射JHU083抗肿瘤效果良好。所有小鼠存活率显著提高,且这种抗肿瘤效果非常持久。
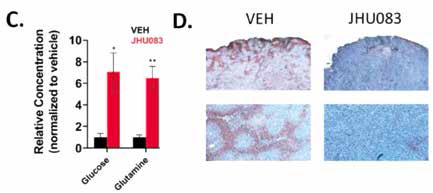
研究者分析发现,谷氨酰胺代谢抑制剂JHU083抑制了葡萄糖通过三羧酸循环和糖酵解等方式代谢,肿瘤依赖的瓦博格效应也陷入瘫痪,肿瘤内的谷氨酰胺和葡萄糖含量显著升高,肿瘤的缺氧状态也改善了,JHU083不仅切断了肿瘤的能量通路,还改造了肿瘤微环境,把免疫细胞的不毛之地变成了宜居场所。
基于JHU083可改善肿瘤微环境,研究者联想到可以联合免疫治疗看其能否提高免疫治疗效果,克服肿瘤对免疫治疗的耐药。将JHU083和PD-1抑制剂联合用于对PD-1抑制剂耐药的MC38细胞系,发现同时给药,原本对PD-1抑制剂无反应的MC38,接种小鼠同时给予JHU083和PD-1抑制剂可100%完全缓解。
研究者还发现,JHU083单药抗肿瘤活性依赖于CD8+T细胞,提示JHU083可通过影响肿瘤和T细胞代谢,增强免疫系统的抗肿瘤能力,JHU083是一种既能破坏肿瘤微环境,又能增强T细胞抗肿瘤效果的小分子药物。
(编译 王晗)


