研究揭示PM2.5促肺癌机制
英国 Francis Crick 研究所Hill等报告的研究显示,PM2.5没有在肺细胞中诱发新的促癌突变,而是促进大量巨噬细胞进入肺组织,释放IL-1β创造炎性环境,让肺部原本存在的携带致癌突变(EGFR或KRAS)的正常肺细胞恶变,研究揭示了PM2.5驱动肺癌的机制。( Nature. 2023; 616: 159-167)
研究者分析了英国、加拿大、中国和韩国32 957例肺癌患者的数据,发现仅3年的高PM2.5暴露可能就足以使EGFR突变驱动的肺癌发生,或许一定程度上也解释了为何中国肺癌患者EGFR突变携带率较高。

世界卫生组织在2021年发布的报告显示,空气污染每年造成700万人死亡,其中99%的人生活在空气质量较差(年平均污染物超过5μg/m3)的地区,空气污染对人类的健康有重大威胁。虽然已有很多研究发现PM2.5与患心脏病或肺癌等疾病的风险增加发生有关,但学界对空气污染导致肺癌具体机制还缺乏清晰的认知。
近年的研究数据表明,许多致癌物不会在肿瘤中留下可检测的DNA突变特征,且在从不吸烟的肺癌患者(LCINS)肿瘤中,也未发现外源性致癌基因突变。研究者在分析TRACERx 421队列中的肺腺癌基因组后发现,在7%~12%的吸烟者肺癌患者的肿瘤中也未找到吸烟相关的致癌突变特征。
于是研究者提出一个假设:空气污染物可能促进肺组织微环境的炎症变化,使预先存在的突变克隆增殖,进而引发癌症。
研究者选择研究由EGFR突变驱动的肺癌与空气污染之间的关系。EGFR突变在从不吸烟的肺癌患者中流行率很高,远高于吸烟的肺癌患者。或许就是空气污染改变了肺组织的微环境,促进了EGFR突变驱动肺癌的发生。
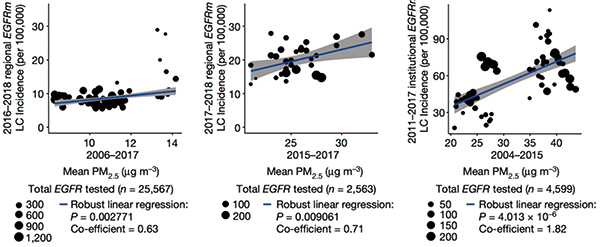
研究者分析了英国、加拿大、韩国和中国台湾肺癌患者基因组数据和当地PM2.5数据,发现与低暴露(<6.77μg/m3)相比,高暴露(>7.27μg/m3)3年后,EGFR驱动的肺癌病例的频率明显更高(40% vs 73%,P=0.03)。
研究者分析了英国生物库中407 509名受试者的数据,发现PM2.5水平与肺癌总体发病率有关(HR=1.08,P≤0.001)。提示空气污染对肺癌的驱动作用不限于EGFR驱动的肺癌。
研究者认为,EGFR驱动的肺癌发病率与PM2.5暴露水平之间存在关联,且3年的空气污染暴露足以让这种关联显现出来。
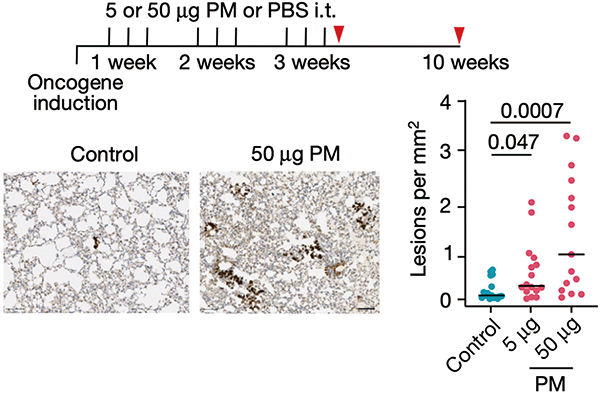
研究团队让肺部表达EGFR L858R的肺腺癌小鼠模型,分别暴露于PBS、5μg和50μg的细颗粒物,发现与PBS对照组相比,露于5μg和50μg细颗粒物的小鼠肺部肿瘤负担更大,且呈现出剂量依赖性。
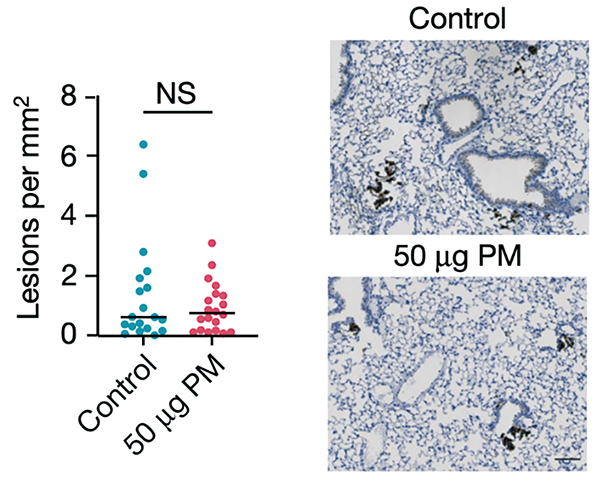
将EGFR L858R的表达限制在肺泡Ⅱ型上皮细胞(AT2)内,细颗粒物也增加了肿瘤的负担。即使在EGFR L858R诱导表达之前暴露于细颗粒物也会增加肺部肿瘤负担。在KRAS G12D肺癌小鼠模型中,暴露于细颗粒物也会增加肺部肿瘤负担。这些数据表明,在致癌的KRAS和EGFR小鼠模型中,无论在致癌基因表达之前还是表达之后暴露于细颗粒物,均可促进肺部肿瘤的进展。细颗粒物促癌确实不是通过增加突变实现的,而是依赖于免疫系统,一旦小鼠免疫缺陷,细颗粒物就没有促癌作用。
研究者发现,在细颗粒物的刺激下,巨噬细胞会释放IL-1β,IL-1β信号是促进细颗粒物介导EGFR驱动的肺癌所必需的,用抗IL-1β抗体阻断这一过程,可抑制细颗粒物的促癌作用。
基于肺组织的转录组数据,研究团队发现与AT2处于祖细胞(成体干细胞)状态和巨噬细胞招募有关的基因表达上调。回顾性分析一个人体研究的数据后,研究者发现了类似现象。亦即EGFR L858R AT2细胞在暴露于细颗粒物后,会发生转录重编程,进入有侵略性的祖细胞状态。不过,只有在EGFR L858R和细颗粒物同时存在的情况下,AT2才能进入祖细胞状态。
结合前面巨噬细胞的研究数据,研究团队复原了细颗粒物诱发肺癌的全过程:在细颗粒物的刺激下,肺上皮细胞会招募巨噬细胞进入肺部,细颗粒物又刺激巨噬细胞释放IL-1β,导致EGFR L858R AT2重编程,进入祖细胞状态,成为启动肺癌的种子。
可见,携带EGFR或KRAS突变的人,若生活在空气污染严重的地区,就有危险了。研究团队分析了不同队列的监测数据,在一个有295例健康肺组织样本的队列中,发现54例(18%)携带有EGFR驱动突变;在81个健康肺组织样本中,发现43个(53%)携带有KRAS驱动突变。在每554 500个健康肺细胞中才有1个携带致癌性EGFR突变的细胞。年龄与突变数间存在显著相关性。
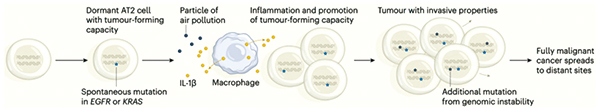
该研究再次证实了空气污染与肺癌之间存在因果关系,还揭示了背后的机制,让学界对空气污染促肺癌有了更深入的了解。
(编译 崔益新)














