乳腺癌新辅助治疗临床试验疗效终点研究
发布时间:2023-07-26
点击量:
美国MD安德森癌症中心Litton等报告的NeoSTEEP试验显示,除病理完全缓解(pCR)率外的临床研究终点,应根据肿瘤的临床和生物学特点及所研究的治疗药物来选择。要获得有临床意义的试验结果及进行跨试验之间的结果比较,预设的定义及干预条件都一致是首要的。(J Clin Oncol. 2023年7月11日在线版)
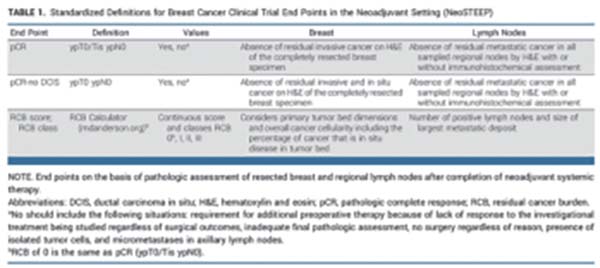
疗效终点标准化定义(STEEP)标准于2007年建立,并于2021年更新(STEEP 2.0),该标准提供了乳腺癌辅助治疗终点的标准化定义。STEEP 2.0明确新辅助临床试验需要另外设定终点。多学科NeoSTEEP专家工作组严格评估并统一了乳腺癌新辅助临床试验终点。
工作组聚焦于中有疗效结局的临床试验中的新辅助治疗终点,病理学终点和至事件发生的生存终点。特别考虑的因素包括亚型和治疗方法、影像学、术中淋巴结分期、双侧和多灶性疾病、相关组织收集以及美国FDA的相关规定等。
工作组推荐pCR的首选定义为在完全切除的乳房标本和所有取样的区域淋巴结中,没有残留的浸润性癌(AJCC分期:ypT0/Tis ypN0)。残余癌症负荷(RCB)应作为次要终点,以方便将来评估其效用。激素受体阳性疾病的研究需要设立替代终点。至事件发生生存终点应特别注意计算的起始点。临床试验应包括从随机分组开始计算的终点(无事件生存和总生存),以获取术前进展事件和死亡事件数据。符合STEEP 2.0标准的次要终点,从根治性手术开始计算,也是适用的。活检方案、影像学和病理淋巴结评估的规范和标准化也至关重要。
(编译 刘畅)














