SPOTLIGHT研究总生存结果会上公布
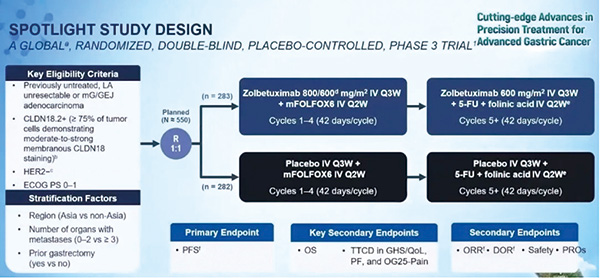
会上,SPOTLIGHT研究最终总生存结果进行了报告,该全球、多中心、双盲、Ⅲ期随机临床研究,聚焦于评估Zolbetuximab联合mFOLFOX6方案(奥沙利铂+亚叶酸+氟尿嘧啶)作为一线治疗CLDN18.2+/HER2-局部晚期不可切除或转移性胃或胃食管交界(mG/GEJ)腺癌患者的疗效。
所有入组患者均为CLDN18.2阳性(定义为 ≥75% 的肿瘤细胞显示中度至强膜性 CLDN18 染色),排除HER2阳性患者。主要终点是无进展生存期(PFS),而总生存期(OS)则是关键次要终点之一。
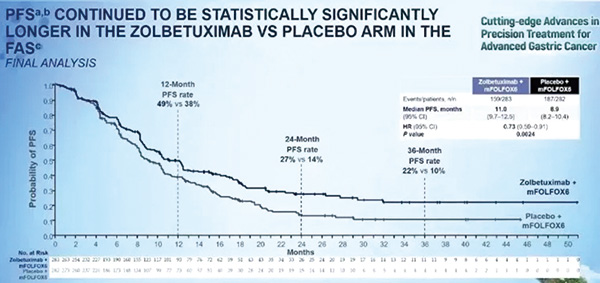
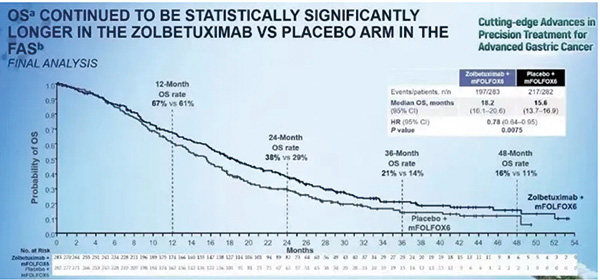
该研究在初步分析中已经展示了PFS和OS的显著改善。本次更新的最终研究数据显示,Zolbetuximab组与安慰剂组的中位PFS分别为11个月和8.9个月,中位OS分别为18.2个月和15.6个月,两年的OS率分别为38%和29%。PFS和OS的生存曲线(Kaplan-Meier曲线)分离得十分清晰,特别是在约3个月之后,这种差异在长期的随访中依然保持稳定。此外,在亚组分析中,大多数亚组均显示出与总体患者人群相同的获益趋势。
符合方案集(PPS)人群的分析显示,在排除了因毒副作用而提前终止治疗的患者后,PFS的Kaplan-Meier曲线显示出更大的分离度(风险比降低至0.65),即Zolbetuximab组PFS和OS的改善更加明显,两组的中位生存期差异接近5个月。尽管这是一项探索性分析,但其结果可能强调了持续治疗的重要性。早期识别并早期干预停止治疗的患者,有望为他们带来更好的生存结果。
安全性方面,在使用Zolbetuximab治疗时,恶心和呕吐是最常见的不良反应。约60%的患者在接受Zolbetuximab治疗时需要剂量调整,而14%的患者因毒副作用而停止治疗。两组之间所有的治疗期间不良事件(TEAE)发生率差异约为20%,而3级TEAE的差异约10%。此次更新的分析中没有发现新的安全性问题。
研究中,恶心和呕吐通常发生在输液后的早期,尤其在首次输注期间发生率较高,但后续周期中发生率明显下降。可见第一个治疗周期的管理对于减轻胃肠道不良反应至关重要。此外,需要调整剂量或中断治疗的患者的首次输注速度往往较快,表明降低首次输注的速度可能有助于减少毒副作用。
(编译 张嘉佳)














