Darolutamide延长前列腺癌患者无转移生存
发布时间:2018-11-07
点击量:
日前,拜耳公司宣布,其用于评估Darolutamide治疗非转移性去势抵抗前列腺癌(nmCRPC)患者疗效及安全性的Ⅲ期临床试验ARAMIS已结束,研究达到了主要研究终点:与安慰剂相比,Darolutamide显著延长患者无转移生存期。试验中观察到的Darolutamide的安全性和耐受性与先前发表的有关该药物的数据一致。
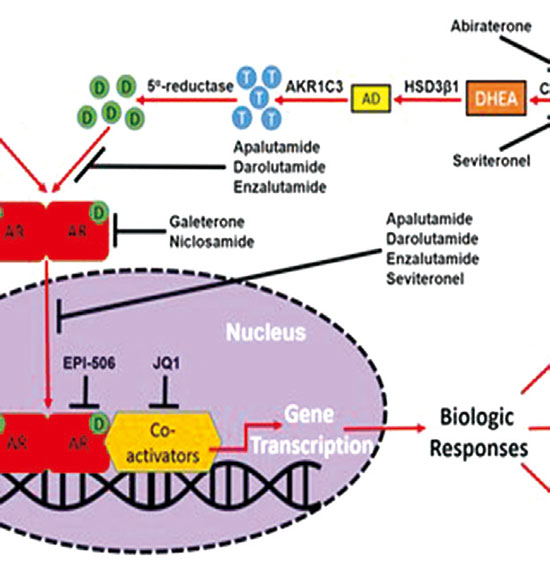
Darolutamide是一款新一代、具有独特化学结构的口服非甾体雄激素受体拮抗剂,与AR受体具有高亲和力,抑制其功能及核内转移,具有较强的拮抗作用和抑制前列腺癌细胞的受体生长的作用。该药物已被美国FDA授予治疗nmCRPC男性患者的快速通道地位。
ARAMIS研究是一项多中心、随机、双盲、安慰剂对照Ⅲ期临床试验,评估口服Darolutamide对目前正在接受雄激素剥夺疗法(ADT)的具有疾病转移风险nmCRPC患者的安全性和有效性。
超过1500例患者按2 : 1比例被随机分组,分别接受600 mg bid的Darolutamide或安慰剂治疗。主要研究终点是无转移生存期(MFS),次要终点是总体生存期(OS)、首次症状性骨骼事件发生时间、开始第一次细胞毒性化疗的时间、疼痛进展时间以及Darolutamide安全性和耐受性情况。
拜耳相关负责人表示,尽管nmCRPC治疗领域最近取得一些进展,但仍有待更有效的治疗选择,以期推迟转移瘤的时间,使患者得到疾病控制。该研究结果令人鼓舞,研究将在近期举行的国际学术会议上报告。
除完成ARAMIS试验外,拜耳还与合作伙伴Orion进行了Ⅲ期临床试验ARASENS研究,评估Darolutamide在转移性激素敏感性前列腺癌(mHSPC)患者中的安全性和有效性,试验预计将于2022年完成。
(编译 王建国)














