NEWS CENTER
全球肿瘤快讯
多发性骨髓瘤新方案获FDA批准
作者:丁建祥
发布时间:2018-12-05
点击量:
日前,百时美施贵宝(BMS)与艾伯维(AbbVie)联合宣布,美国FDA已批准免疫刺激疗法Elotuzumab(Empliciti,埃罗妥珠单抗)联合Pomalidomide(Pomalyst,泊马度胺)及低剂量地塞米松方案(EPd),用于先前已接受至少两种疗法(包括来那度胺和一种蛋白酶体抑制剂)的成人多发性骨髓瘤(MM)患者。之前,FDA已授予该三药方案EPd的优先审查资格。(自FDA)
此次批准是基于Ⅱ期临床研究ELOQUENT-3数据。该研究是一项阳性对照随机临床研究,在117例既往已接受过至少两种疗法治疗失败的复发性/难治性MM患者中,评估了三药方案EPd相对于标准两药方案(泊马度胺+地塞米松,Pd)的疗效和安全性。
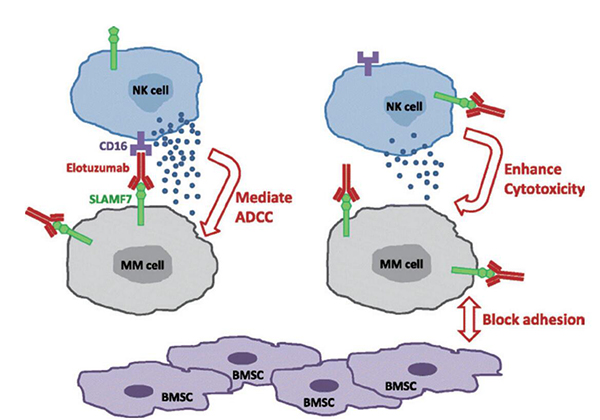
ELOQUENT-3研究是首个评估标准治疗方案联合单抗药物的随机研究,EPd方案是基于Pd为对照方案的随机临床研究数据获批的首个三药方案。
研究结果显示,与Pd组相比,EPd组中位PFS显著较长(10.25个月 vs. 4.67个月),进展或死亡风险降低46%(HR=0.54,P=0.0078)。EPd组总缓解率(ORR)是Pd组的2倍(53.3% vs 26.3%,P=0.0029),更高比例的患者获得非常好或更好部分缓解(20% vs. 8.8%)。EPd组严重不良反应发生率为22%,Pd治疗组为15%,不良反应导致停药率分别为5.0%和1.8%。
(编译 丁建祥)
分享到:
上一篇:
外周T细胞淋巴瘤一线治疗获批
下一篇:
急性髓性白血病两种新药获FDA批准
最新新闻
28 2026.02
我院召开2025年度领导干部述职暨民主测评会
14 2026.02
共绘荣光•同启华章丨北京大学肿瘤医院建院50周年LOGO正式发布
06 2026.02
2025年中华医学科技奖揭晓 我院2项成果获奖
02 2026.02
我院召开2025年度党支部书记现场述职会
23 2026.01
寒冬中的生命接力——我院两位医生火车站救助急症旅客

联系我们
咨询电话:010-88121122
地址:北京海淀区阜成路52号(定慧寺)
邮编:100142
友情链接
网站备案

北大肿瘤医院APP

微信服务号

北肿微课堂

微信订阅号
微博










