靶向PD-L1/TGF-β的新一代抗体研究报告
北京大学肿瘤医院沈琳教授领衔开展的靶向PD-L1和TGF-β(转化生长因子β)的双功能融合蛋白SHR-1701治疗晚期实体瘤患者的Ⅰ期研究进行了口头报告,SHR-1701是由恒瑞研发的一种靶向PD-L1/TGF-β双功能的融合蛋白,也就是我们常说的“双抗”(双特异性抗体),这项Ⅰ期研究,评估SHR-1701在难治性实体肿瘤中的安全性和初步抗肿瘤活性。目前该研究还在进行当中,正处于剂量爬坡和人群扩展阶段。
PD-1/PD-L1和TGF-β通路具有独立和互补的免疫抑制功能,肿瘤微环境中 TGF-β 介导的信号传导可以通过包括上皮细胞间质转型(EMT)在内的多种机制促进肿瘤的侵袭、迁移和转移。TGF-β在癌症和包括癌症相关成纤维细胞(CAF)在内的间质细胞中表达。TGF-β可通过激活CAF、刺激免疫抑制和促进血管因子来维持肿瘤进展。
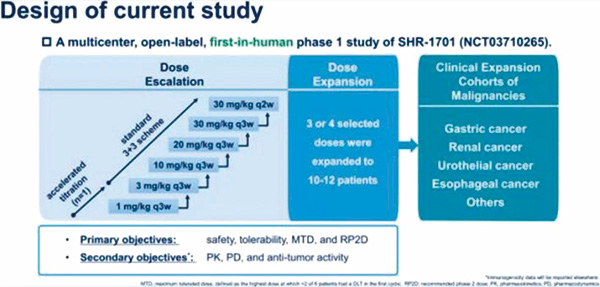
该研究的剂量递增期通过加速滴定(1 mg/kg Q3W)开始,然后切换到 3+3 方案(3 mg/kg、10 mg/kg、20 mg/kg 、30 mg/kg Q3W 和 30 mg/kg Q2W)。剂量以10 mg/kg、20 mg/kg、30 mg/kg Q3W 和 30 mg/kg Q2W 的剂量进行扩增。主要目的是确定SHR-1701的安全性、耐受性、最大耐受剂量(MTD)和Ⅱ期临床研究推荐剂量(RP2D)。
17例患者被纳入剂量递增队列,尚未观察到剂量限制性毒性(DLT),也没有达到 MTD。另32例患者被纳入剂量扩展队列。药物的中位暴露时间为6.0周(2.0~78.6周),从目前数据来看SHR-1701未产生新的不良反应,安全性较好。最常见的治疗相关不良反应(TRAE)是ALT/AST升高、贫血、甲状腺功能减退和胆红素/结合胆红素升高,发生率>15%。
PK分析显示,SHR-1701在1~30 mg/kg剂量范围内与剂量暴露呈线性关系。所有剂量组外周血PD-L1靶标占有率均超过90%,TGF-β1几乎完全诱捕。49例患者中,45例患者完成至少一次疗效评估。
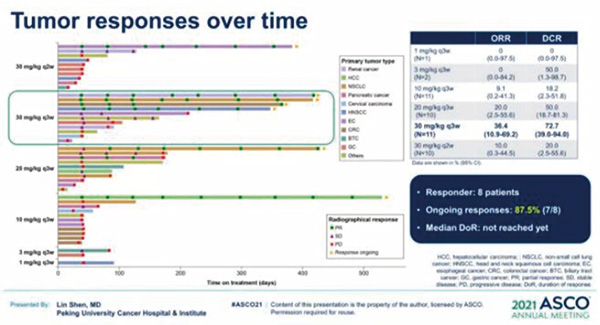
客观缓解率(ORR)为17.8%。8例患者达到部分缓解(PR),分别为2例肺腺癌,1例肝癌, 1例食管鳞癌, 1例错配修复缺陷(dMMR)结直肠癌, 1例肾癌,1例会阴癌,1例胰腺腺泡细胞癌]。疾病控制率(DCR)为40.0% (18/45例)。87.5%(7/8例)的患者持续缓解,中位缓解持续时间(DoR)未达到。基于安全性、PK、PD和疗效数据,研究推荐SHR-1701 30 mg /kg Q3W作为RP2D。
研究解读
默克公司的Bintrafusp alfa(M7824)是第一个进入临床研究的靶向PD-L1和TGF-β的双功能融合蛋白,M7824由于在人乳头瘤病毒(HPV)相关癌症、胆管癌(BTC)和胃癌等难治性癌症方面中显示出较好的抗癌活性,不过近期因中期分析结果不佳终止了PD-L1/TGF-β双抗M7824的肺癌Ⅲ期临床研究.
沈琳教授指出,SHR-1701的Ⅰ期研究能得出的结论是SHR-1701是值得探索的双特异性抗体,初期疗效可观,安全性良好。未来,SHR-1701未来是否能实际应用于临床?它能在哪个瘤种中发挥效果?疗效是否可以超越传统单抗?目前这些还都是未知数。
(编译 韩晶)


