ADC新药Dato-DXd在TNBC中疗效可期

会上报告了Ⅰ期TROPION-PanTumor01研究结果,探索了Datopotamab deruxtecan(TROP2靶向抗体偶联药物,ADC,Dato-DXd)治疗HER2阴性晚期/转移性乳腺癌的疗效及安全性。(摘要号 GS1-05)
Dato-DXd是一种靶向Trop2的ADC药物,由人源化抗TROP2 IgG1单克隆抗体与有效荷载强效拓扑异构酶Ⅰ抑制剂通过稳定的四肽可裂解连接子偶联而成,由第一三共与阿斯利康联合开发。Ⅰ期TROPION-PanTumor01研究的初步结果表明,Dato-DXd在非小细胞肺癌(NSCLC)患者和三阴性乳腺癌(TNBC)患者中有令人鼓舞的抗肿瘤活性和可管理的安全性特征。此次会上公布了TNBC队列的更新结果。
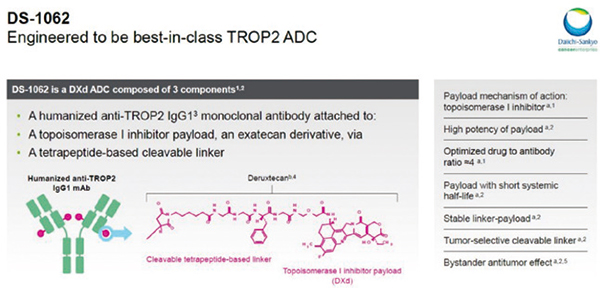
TROPION-PanTumor01(NCT03401385)是一项在既往接受过治疗的实体瘤患者中评价Dato-DXd的Ⅰ期、多中心、开放标签、多队列研究。根据NSCLC患者的剂量递增结果,研究对于既往接受过标准治疗后复发/进展的转移性TNBC和HR+/HER2-乳腺癌患者中给予Dato-DXd,6 mg/kg,每3周一次,静脉给药。2例TNBC患者在选择6 mg/kg进行剂量扩展前接受了8 mg/kg Dato-DXd。由盲态独立中心审查委员会(BICR)根据RECIST 1.1版评估安全性和疗效,包括客观缓解率(ORR)。
结果显示,截至数据截止日期2021年4月6日,44例TNBC患者接受了≥1剂次Dato-DXd,中位年龄为53岁(32~82岁)。30例患者(68%)既往接受过≥2线治疗,19例患者(44%)既往接受过免疫治疗,7例患者(16%)既往接受过PARP抑制剂治疗。中位治疗持续时间为2.8个月(0.7~6.9个月)。中位随访3.9个月(0.3~9.2个月)。
疗效数据显示,在整体患者中BICR评估的ORR为34%,疾病控制率(DCR)为77%(34/44例)。既往未接受过拓扑异构酶Ⅰ抑制剂为基础的ADC药物治疗的患者ORR可达52%。
安全性方面,在95%和35%的患者中分别观察到因治疗导致的任何等级和≥3级的不良事件(TEAE);2例为4级。最常见(≥30%)和≥3级的TEAE包括恶心(58%,0%)、口腔炎(53%,9%)、脱发(35%,N/A)、呕吐(35%,2%)和疲乏(33%,7%)。1例患者发生3级中性粒细胞计数降低;未观察到≥3级腹泻病例。未报告独立委员会判定的治疗相关间质性肺病病例。在5例患者(12%)中观察到严重TEAE;无TEAE与死亡相关。9例患者因口腔炎、疲乏、黏膜炎症、干眼、视网膜渗出和视物模糊(每起TEAE多次计数)降低剂量。3例患者因口腔炎、黏膜炎症、支气管炎和胸部肌肉骨骼疼痛而中断给药。无患者因不良事件中止治疗。
该研究初步结果表明,Dato-DXd在既往接受过治疗的晚期/转移性TNBC患者中表现出有前景的抗肿瘤活性和可管理的安全性特征,值得在乳腺癌患者中进一步进行验证。
(编译 韩娜)


