贝福替尼肺癌一线适应证获批
近日,贝达药业宣布,国家药品监督管理局(NMPA)已正式批准其旗下第三代EGFR-TKI甲磺酸贝福替尼(商品名:赛美纳)新适应证上市,即用于“具有表皮生长因子受体(EGFR)外显子19缺失(19del)或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗” 。
对于EGFR突变晚期NSCLC患者的一线治疗,抗肿瘤能力更强、入脑能力更好的三代TKI已成为优选方案。然而,临床上仍面临着一些诊疗难题。与19del类型不同,EGFR-TKI对21 L858R突变患者的疗效较差,临床预后受到影响;EGFR-TKI的毒性谱各不相同,安全性也是临床选择用药的重要考虑因素;易发脑转移是EGFR突变人群的特点,临床对于EGFR-TKI的颅内病灶治疗效果也提出了更高的要求等。

本次一线适应证获批基于一项随机、对照、多中心、开放性Ⅲ期研究(IBIO-103),由上海市胸科医院陆舜教授、浙江大学医学院附属第一医院周建英教授牵头,入组患者为患者年龄≥18岁,患有组织学证实的局部晚期或转移性ⅢB、ⅢC或Ⅳ期不可切除NSCLC,并证实存在19 del或21 L858R突变。
患者以1∶1的比例随机分配到试验组和对照组,试验组接受贝福替尼口服给药(每日1次,每次75~100 mg),对照组接受埃克替尼口服给药(每日3次,每次125 mg)。自2019年12月24日至2020年12月18日,共568例患者参与筛选,其中362例随机分配至贝福替尼组(182例)或埃克替尼组(180例)。
贝福替尼组中位随访时间为20.7个月(IQR:10.2~23.5个月),埃克替尼组为19.4个月(IQR:10.3~23.5个月)。贝福替尼组由IRC评估的中位无进展生存期(mPFS)为22.1个月,埃克替尼组为13.8个月(HR=0.49,95%CI 0.36~0.68,P<0.0001)。
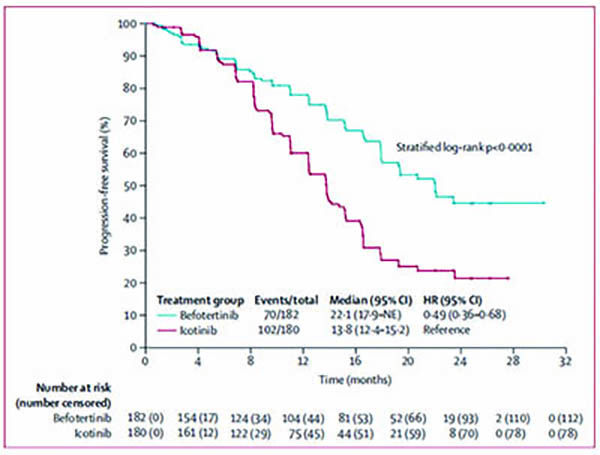
在基线有CNS转移的人群中,两组mPFS存在显著差异:贝福替尼组19.4个月 对比埃克替尼组13.7个月(HR=0.48,95%CI 0.28~0.84,P=0.0086)。根据IRC评估,基线时发生脑转移的患者中,贝福替尼组中位颅内PFS 为24.9个月,埃克替尼组为15.2个月,且两组间颅内客观缓解率差异显著(92.3% vs. 55.6%),进一步展现贝福替尼良好的颅内活性,或可为脑转移患者带来更多临床获益。
在安全性上,IBIO-102和IBIO-103研究结果皆显示,绝大部分患者可耐受贝福替尼治疗。最常见的与治疗相关的不良反应为血小板减少症、头痛、ALT升高等,大多数为1级或2级。
值得注意的是,贝福替尼通过在奥希替尼的吲哚氮原子上引入三氟乙基基团进行了分子结构优化,避免产生AZ5104代谢产物,从而减少腹泻等胃肠道副作用,进一步提高了患者对治疗的耐受性。对于有胃肠道疾病,或其他EGFR TKI治疗过程中出现胃肠道不良反应的患者,贝福替尼无疑是更合适的治疗选择。
(编撰 王宇航)


