Ramucirumab联合多西他赛改善膀胱癌患者预后
新的抗血管生成药物Ramucirumab(Cyramza,礼来公司)联合多西他赛化疗(多个品牌)在晚期或转移尿路上皮癌的二线治疗中显示出令人满意的结果。(摘要号295)
一项随机Ⅱ期临床试验的中期分析显示,与单药多西他赛方案(10.4周)方案相比,Ramucirumab联合多西他赛方案(22周)显著改善膀胱癌患者的无进展生存期(PFS)。
Ramucirumab和Icrucumab都是单克隆抗体药物,均作用于血管内皮生长因子(VEGF),但Ramucirumab作用在VEGF-2,而Icrucumab作用在VEGF-1。
一项Ramucirumab用于二线治疗的Ⅲ期临床研究显示,Ramucirumab延长了总生存期(OS),之后被批准用于治疗胃癌和非小细胞肺癌。该药物在结直肠癌中也显示出一定活性,但截止目前尚未获批这一适应证。
转移性膀胱癌可选择治疗方法有限
Petrylak教授在报告中指出,以顺铂为基础的联合化疗是转移性膀胱癌的标准治疗方案。对于转移性尿路上皮癌患者来说,如一线化疗后出现进展,可选择的治疗方法有限。
Petrylak教授汇报了一项研究,该研究纳入近150例晚期尿路上皮癌患者,所有患者均在接受以铂类为基础治疗方案后1年内疾病复发,ECOG评分为0-1分。患者被随机分配到三组,分别接受多西他赛75 mg/ m2单药静滴 (44例),或多西他赛联合Ramucirumab 10 mg/kg 静滴 d1,21天为1周期 (46例),或多西他赛联合Icrucumab12 mg/kg d1和d8,21天为1周期 (49例),直到疾病进展或出现不耐受的毒性反应停止治疗。该研究的主要研究终点是PFS,出现75%无进展事件后,展开该研究的计划中期分析。
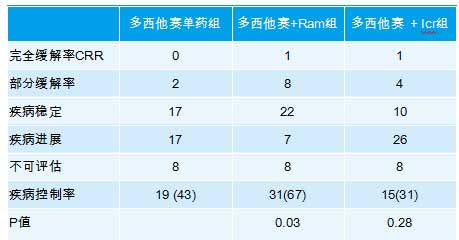
中期分析结果显示,多西他赛单药组PFS为10.4周,多西他赛联合Ramucirumab组为22周(HR=0.388,P<0.001),多西他赛联合Icrucumab治疗组患者的PFS为7周(HR=0.988,P=0.932)。
Petrylak教授表示,该结果具有统计学意义。即便考虑到各种临床因素,如年龄、性别、ECOG评分、既往抗血管生成治疗情况、内脏转移、肝转移或既往含铂化疗情况,Ramucirumab联合多西他赛组的结果更让人满意。
Petrylak教授对于OS数据比较谨慎,因为该数据尚未成熟,但应用Ramucirumab联合多西他赛方案治疗的结果相对于单药多西他赛似乎要好一些 (48.9周vs 33.4周;HR=0.775;P=0.387)。多西他赛联合Icrucumab的OS为27.7周(HR=1.080;P=0.754)。
单药多西他赛组共有5%的患者获得完全或部分缓解(CR和PR), Ramucirumab联合多西他赛组有20%,而多西他赛联合Icrucumab组为10%。
多西他赛联合Ramucirumab组治疗的患者比单药多西他赛组出现更多的不良事件。多西他赛联合Ramucirumab组和单药多西他赛组患者最常见不良反应(所有等级)包括乏力(80.4% vs 75.0%),食欲减退(54.3% vs 43.2%),恶心(54.3% vs 25.0%),神经病变(50.0% vs 38.6%),≥3级粒细胞缺乏性发热(19.6% vs 11.4%),肺炎(13% vs 9.1%),高血压(4.3% vs 0%)。
多西他赛联合Ramucirumab方案显示较好的安全性,支持了该项Ⅲ期临床试验(RANGE试验)的研究初衷。
值得进一步研究
耶鲁大学医学院Daniel P. Petrylak教授和New Haven教授评论表示,计划的中期分析显示,Ramucirumab联合多西他赛方案显著改善患者PFS>11.5周,且将疾病进展风险降低61%。该结果与预设亚组分析的结果一致,且处于可接受的安全范围。
Petrylak教授补充道,该研究的其中一组是研究观察性药物抗血管生成药物Icrucumab(英克隆制药公司)联合多西他赛的临床试验,但该试验没有达到主要研究终点,也就没有进一步研究观察。
纪念斯隆凯特琳癌症中心的Jonathan E. Rosenberg教授指出了该研究的优点和不足之处。Rosenberg教授表示,该研究设计是随机入组,所有的研究终点倾向于同一方向,且患者的11个月中位OS极具意义。对于OS有明确倾向,虽然它不是该研究的主要研究终点,但无疑是趋向了有利的方向。然而,不足之处是OS趋势并不显著,研究者并未使用已知的二次分层因素。总的来说,该联合方案似乎值得进一步研究,毕竟该研究达到主要研究终点且毒性可控。
(编译 孙庆庆 审校 谢晓冬)
表格 总有效率(OR)