HER2扩增、不可切除的局部晚期或转移性胆管癌
HER2双特异性抗体Zanidatamab疗效可期
美国纪念斯隆·凯特琳癌症中心Harding等报告,Zanidatamab在治疗难治性HER2(也称为ERBB2)阳性胆管癌患者时显示出有意义的临床获益和可管理的安全性。这些结果支持Zanidatamab有可能成为HER2阳性胆管癌患者的治疗选择。(Lancet Oncol. 2023年6月2日在线版)
HER2在胆管癌亚群中过度表达或扩增。Zanidatamab是一种HER2双特异性抗体,是针对HER2两个非重叠结构域的新型双特异性单克隆抗体,在HER2表达或HER2扩增的难治性胆管癌中表现出耐受性和初步抗肿瘤活性。
HERIZON-BTC-01是一项全球性、多中心、单组、Ⅱb期临床试验,用于治疗HER2扩增、不可切除的、局部晚期或转移性胆管癌患者,这些患者在既往基于吉西他滨治疗后疾病进展,在北美、南美、亚洲和欧洲9个国家的32个临床试验点招募患者。符合条件的患者年龄为18岁或以上,经中心的原位杂交检测证实为HER2扩增的胆管癌,实体肿瘤反应评价标准1.1版评估至少有一个可测量的靶病灶,ECOG PS评分为0或1。
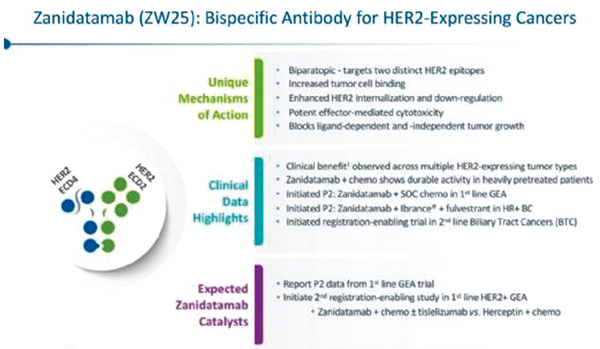
根据HER2免疫组化(IHC)评分将患者分队列1(IHC 2+或3+;HER2阳性)和队列2(IHC 0或1+)。患者接受Zanidatamab(20 mg/kg,静脉给药)每2周。主要终点是通过独立的中心评价确定的队列1的客观缓解率。所有接受任何剂量Zanidatamab的患者接受抗肿瘤活性和安全性评估。该试验正在进行中,现已停止招募。
2020年9月15日至2022年3月16日,87例患者入组了HERIZON-BTC-01:队列1有80例患者(45例女性,35例男性;52例为亚洲人;中位年龄为64岁),队列2有7例(5例男性,2例女性;5例亚洲人;中位年龄为62岁)。
在数据截止时(2022年10月10日),18例(21%)患者(队列1有17例,队列2有1例)继续接受Zanidatamab;69例(79%)停止治疗(64例患者影像学上进展)。中位随访持续12.4个月(IQR:9.4~17.2个月)。通过独立中心评价,队列1中有33例患者(41.3%,95%CI 30.4%~52.8%)被证实获得客观缓解。16例(18%)患者出现3级治疗相关不良事件;最常见的是腹泻(4例)和射血分数降低(3例)。无4级治疗相关不良事件,无治疗相关死亡。
(编译 曹莉)


