胶质母细胞瘤 国人研究发现增强放化疗敏感性的靶向药
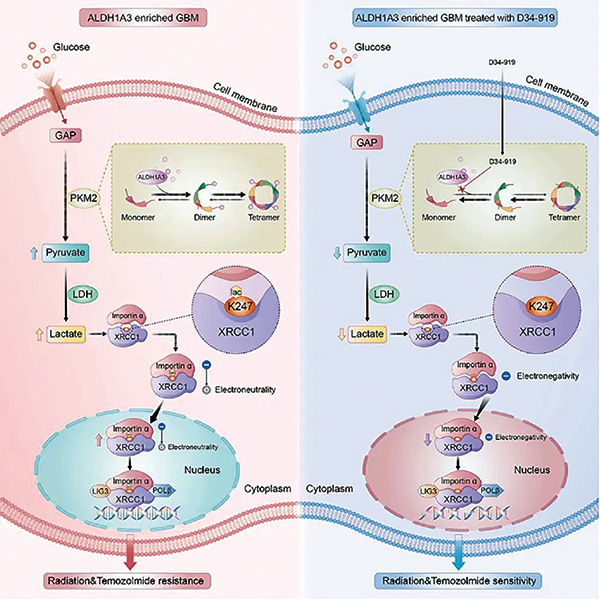
首都医科大学附属北京天坛医院神经外科学中心江涛院士、张伟教授等发表研究,首次阐明了胶质瘤干细胞生物标志物ALDH1A3,通过别构激活糖酵解通路关键酶PKM2,介导胶质母细胞瘤葡萄糖代谢重编程并导致乳酸堆积的分子机制。(Cell Metab. 2024年8月6日在线版)
该研究证实细胞内堆积的乳酸可促使DNA损伤修复相关蛋白XRCC1发生乳酰化修饰和核转运增加,最终介导胶质母细胞瘤的放化疗抵抗。
该研究还基于高通量小分子药物筛选平台鉴定出靶向PKM2别构激活位点的小分子抑制剂——D34-919,并通过体内外模型证实D34-919药物可阻断ALDH1A3与PKM2互作,逆转ALDH1A3介导的糖酵解异常激活,抑制肿瘤细胞DNA损伤修复,从而增强胶质母细胞瘤对放化疗的敏感性。
该研究证实,胶质瘤干细胞重要标志物ALDH1A3表达阳性的胶质母细胞瘤对常规放化疗均不敏感,并通过胶质瘤干细胞数据库及代谢组学分析,首次证实ALDH1A3通过与糖酵解限速酶PKM2互作,激活糖酵解通路并介导肿瘤细胞内乳酸堆积。该发现阐明了胶质母细胞瘤Warburg效应的调控机制,并且证实ALDH1A3通过异常激活糖酵解通路介导胶质母细胞瘤的放化疗抵抗。
该研究发现,ALDH1A3介导的肿瘤细胞内乳酸堆积,主要通过DNA损伤修复相关蛋白XRCC1 K247位点的乳酰化修饰,促进胶质母细胞瘤的DNA损伤修复功能,最终导致胶质母细胞瘤对放化疗的抵抗。该研究研发了XRCC1 K247位点乳酰化修饰的兔源特异性抗体,可以作为临床检测工具,用于检测临床样本中XRCC1的乳酰化修饰水平。
基于上述机制研究,研究者通过小分子化合物高通量筛选平台,成功筛选出靶向PKM2激活位点的小分子抑制剂——D34-919,并利用胶质瘤干细胞系、小鼠原位成瘤模型以及胶质瘤类器官模型证实D34-919小分子药物可以有效阻断ALDH1A3与PKM2互作,降低肿瘤细胞内乳酸浓度及XRCC1乳酰化修饰水平,从而抑制DNA修复功能,提高胶质母细胞瘤对放化疗的敏感性。在动物模型中,该药物还表现出较高的血脑屏障通过率及良好的安全性,已申报国家发明专利,有望成为胶质母细胞瘤患者全新的靶向药物。
该研究揭示了非糖酵解酶ALDH1A3与PKM2的相互作用增强糖酵解和乳酸生成的机制,并展示了Warburg效应通过乳酸介导的蛋白乳酰化调控DNA损伤修复的全新发现,干预这一过程在提高胶质母细胞瘤对DNA损伤诱导疗法的敏感性方面具有令人期待的潜力。
(编译 张嘉佳)