人工智能肿瘤诊断工具表现优秀
美国哈佛医学院、斯坦福大学和布莱根妇女医院等机构合作,带来了全新一代的肿瘤诊断AI,它能在多达19种癌症类型中发挥肿瘤诊断、肿瘤微环境定位、治疗策略引导、生存率预测等多种能力,并且预测准确性要优于过往的AI诊断系统。(Nature. 2024年9月4日在线版)
人工智能(AI)正为肿瘤诊断领域带来了越来越多的革新,借助一些已有的肿瘤病理性图像,AI通过识别和训练之后就能够判断新的组织样本是否存在肿瘤,也能预测肿瘤组织的侵袭性、增殖能力。现有的肿瘤诊断AI可在少数的肿瘤类型中实现一定程度的诊断和预测,但这还远非AI的全部实力。
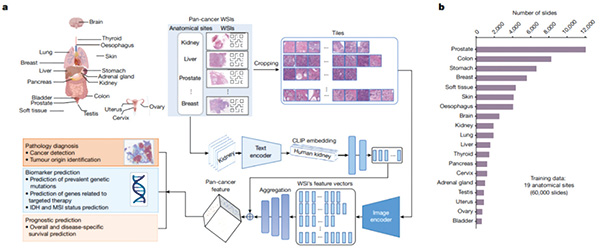
以往,肿瘤诊断AI往往基于特定方法、样本的组织病理学图像进行训练,因此面对来自不同方法获得的图片,不同人群、癌症类型的样本作用就有限了。但新研究展示的全新AI模型——CHIEF(临床组织病理学图像评估基础),它的训练过程更为复杂。
首先它需要经过1500万张没有经过任何标记的图片训练,随后CHIEF还要接受6万多张全视野组织切片的训练,样本包括肺部、胃部、结肠、大脑、肝脏、胰腺、皮肤和肾上腺等19种组织,这主要是让CHIEF能够将特定部位的变化与完整组织联系起来,而不仅仅只局限对某一个小区域的了解和预测。
完成了上述训练后,研究者尝试让CHIEF对来自全球24个医院,32个独立数据库中的近2万张全视野病理组织切片图进行了分析。与目前最先进的深度学习方法相比,CHIEF完成各类任务的表现总体提升了36.1%,包括癌细胞检测,肿瘤起源辨别,预测癌症患者治疗效果,以及分辨与治疗反应相关的基因和DNA模式。
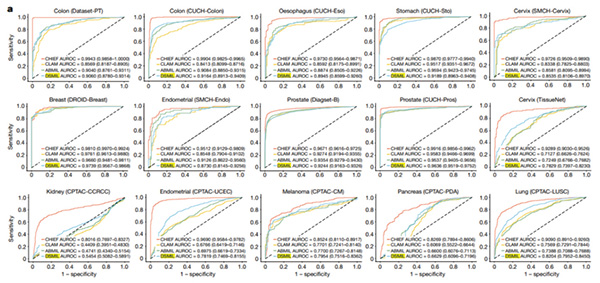
而在癌症检测方面,面对包含11种癌症类型的15个数据库样本时,CHIEF的预测评价指标AUROC(接受者操作特征曲线下面积,用于判断模型准确率)可达到0.9397(AUROC越接近于1,表明模型能更好地区分正负样本);相同的任务下,已有的深度学习模型的AUROC在0.80到0.84之间。对于其他任务,比如预测之前从未见过的手术切除组织病理切片图,CHIEF的AUROC也可以超过0.9。
肿瘤基因组构成能决定肿瘤的特性、演化以及对治疗的敏感程度。而CHIEF也能以优于当下AI的准确性来识别测试样本中的基因特征,包括与癌细胞生长、抑制相关的基因模式,此外CHIEF在观察全组织图像时,还可识别出54种常见的癌症基因突变。
在人类患者中,CHIEF也可有效地预测患者的死亡风险,且它还发现与生存期较短的患者相比,生存期长的患者肿瘤中含有更多的免疫细胞,这些免疫细胞有助于帮助攻击肿瘤。而CHIEF在生存期短的患者肿瘤中发现了一些异常特征,比如细胞间连接减弱,细胞核有更多非典型特征。
研究者指出,CHIEF模型在跨越多类型肿瘤中的任务中展现出卓越的效能,研究者希望它能像ChatGPT一样表现出更广泛的作用。为此,研究者将继续给CHIEF进行更多的组织图像训练,同时增加一些癌前病变样本,进一步提升CHIEF在肿瘤诊断和预测分析中的准确性。
(编译 王微微)


