研究发现减少CD8+ T细胞耗竭的方法
美国圣裘德儿童研究医院Kang等基于对骨髓增生异常综合征(MDS)患者的观察,发现了调控T细胞从耗竭前体状态(TPEX)向终末耗竭(TEX)状态分化的关键表观遗传靶点,对它们进行抑制可使T细胞更好地保持干细胞样状态,更好地响应现有的免疫治疗。(Science. 2024年10月11日在线版)
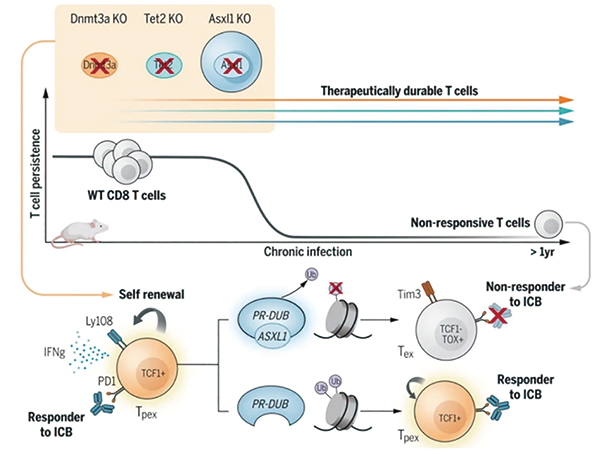
研究发现,在MDS患者典型临床表现克隆造血中常见的DNMT3A、TET2和ASXL1基因突变,能使一部分T细胞长期保持干性,延缓向TEX状态分化,从而扩大了它们响应免疫治疗的时间窗,携带上述基因突变的T细胞,在实验中可在慢性抗原刺激下存活超过1年;其中ASXL1突变是被首次揭示与T细胞持久力有关,研究者专门揭示了它经由表观遗传调控T细胞自我更新的机制,将ASXL1抑制也可与现有免疫治疗协同增效。
既往在CAR-T细胞上开展的研究已证实,干预DNMT3A和TET2的正常功能可延缓T细胞进入终末耗竭阶段,使它们持久存在以改善细胞疗法的疗效;而ASXL1则是圣裘德儿童研究医院研究团队此前的研究成果,T细胞存在该突变的MDS患者接受免疫+化疗方案治疗(阿替利珠单抗+吉西他滨),预后显著较野生型或仅有髓系ASXL1突变的患者更好。
该研究中,研究者首先用CRISPR敲除了LCMV特异性CD8+ T细胞的DNMT3A、TET2和ASXL1基因,再将它们回输到相应感染小鼠体内,发现在LCMV病毒长期存在、即抗原慢性刺激的情况下,这些LCMV特异性CD8+ T细胞可存在超过1年,且通过增殖保持数量大致稳定,而野生型LCMV特异性CD8+ T细胞的数量在2个月后就大大降低。
敲除DNMT3A、TET2和ASXL1也使CD8+ T细胞的干细胞特征相关标志物(Ly108)表达明显上升,而PD-L1、TIM-3等耗竭标志物表达下调,且小鼠脾脏和肺部也明确存在TCF1+干细胞样CD8+ T细胞,提示敲除DNMT3A、TET2和ASXL1保存下来了一部分具有干细胞样特征的CD8+ T细胞亚群,使它们成为响应免疫治疗的火种。
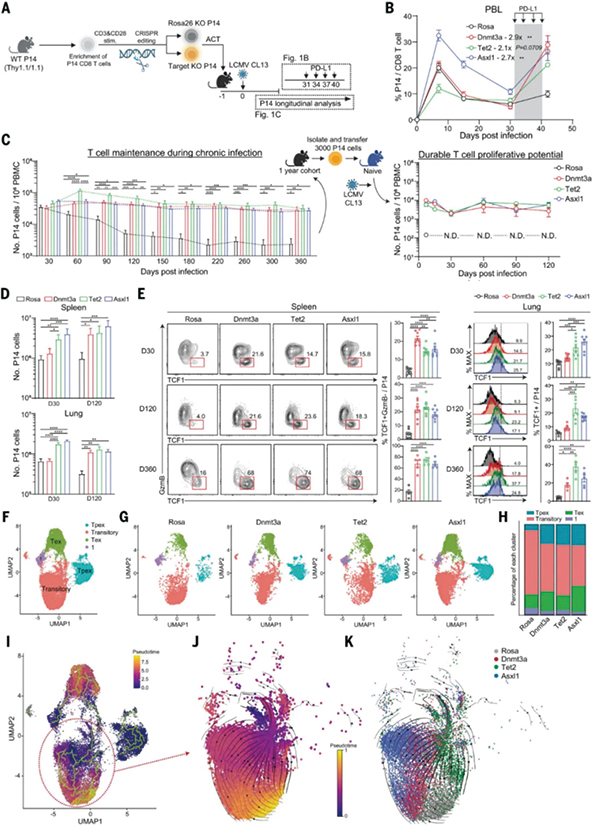
研究者开始探索ASXL1维持T细胞自我更新能力的表观遗传调控机制。分析显示,敲除ASXL1会改善T细胞的染色质可及性,并通过降低多梳抑制性去泛素化酶(PR-DUB)复合物稳定性,在TPEX向TEX状态分化的过程中,调控组蛋白H2AK119位点单泛素化修饰(H2AK119Ub)等多种组蛋白修饰,从而调节T细胞维持干细胞样特征和细胞毒效应的关键基因表达水平,起到保存火种的作用。
在小鼠实验中,敲除CD8+ T细胞的ASXL1可有效改善它们在小鼠体内和过继后的抑癌效果,也能与PD-1/L1抑制剂治疗实现协同增效。对人类实体瘤患者的分析也证实,ASXL1突变可为患者带来生存优势。
将肿瘤微环境内因抗原慢性刺激转入耗竭状态的CD8+ T细胞唤醒,使其重新活化为效应CD8+ T细胞,是PD-1/L1抑制剂免疫疗法起效的关键。减少T细胞耗竭的发生,维持免疫疗法的持久疗效,该研究成果如何转化为新的治疗策略值得深入探讨。
(编译 张俊熙)


