研究者发现可颠覆CAR-T疗法的基因突变
肿瘤免疫疗法大咖、CAR-T疗法先驱、第一款CAR-T疗法Kymriah之父Carl June教授团队发表重磅研究,称发现了可改变传统CAR-T疗法的基因突变,抑制TET2基因表达,能显著增加CAR-T细胞的增殖和抗肿瘤能力,让原本治疗无望的白血病患者得到临床治愈。
1例获得完全缓解的慢性淋巴细胞白血病患者,体内的CAR-T细胞竟有94%都是来自同一祖先,意味着CAR-T疗法所需的最低剂量,或许只是一个细胞而已。
CAR-T疗法为突破性抗肿瘤免疫疗法,通过分离出体内免疫T细胞,体外进行基因改造,插入识别肿瘤细胞抗原的受体,回输患者体内。2017年,第一款和第二款CAR-T疗法相继获美国FDA批准上市,人类抗癌史翻开新篇章,2017年被称为CAR-T年。CAR-T疗法最令人担忧的严重不良反应包括细胞因子释放综合征(CRS),为尽量将CRS控制在可控范围内,一般分三次给患者注射经过修饰的T细胞,剂量依次递增。
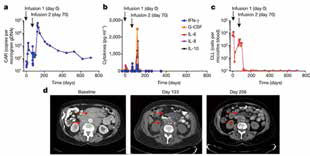
在用Kymriah治疗慢性淋巴细胞白血病(CLL)的Ⅰ期临床试验过程中,1例患者引起June教授注意。患者接受了两次治疗后,病情依旧未得到有效缓解,直到治疗后第50天,才出现了CRS,提示CAR-T疗法终于有了效果。最后一个疗法结束后,该患者很快获得完全缓解,随访4.2年未出现复发,5年无癌生存,得到临床治愈。一般治疗开始后,患者要么迅速起效,要么完全无反应,为何该患者过了50多天才突然起效?
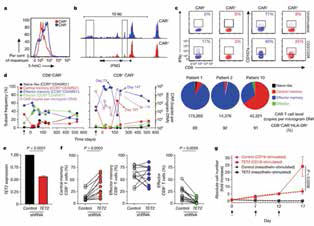
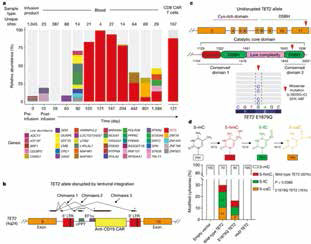
研究者对该患者体内T细胞进行分析发现,在该患者体内,94%的CAR-T细胞都来自于同一祖先,也就是说,在该患者治疗过程中,一个CAR-T细胞就达到了理想的治愈效果。
进一步基因分析发现,原来是偶然在用慢病毒转染进行基因改造过程中,CAR序列被无意插入到一个名为TET2的等位基因里,导致该基因功能障碍。TET2基因结构被破坏导致失活后,CAR-T细胞开始快速繁殖,把患者体内的白血病消灭干净。
TET2是血细胞形成过程中的关键调控基因,正常情况下,TET2控制血细胞生成,避免其过度增殖,TET2突变与许多血液系统肿瘤有关,其失活可能会导致造血干细胞和祖细胞的加速增殖。
为验证TET2基因是CAR-T疗法起效的关键,研究者用shRNA对其表达进行了抑制。果然,TET2基因的表达水平下调后,CAR-T细胞出现显著扩增。提示TET2失活可能有助于产生强力的CAR-T细胞。这些CAR-T细胞不仅能快速起效,还能长久生存。
研究者乐观地估计,或许单个CAR-T细胞,就足以有效控制晚期白血病患者的病情。不过这只是单个病例,且TET2是个抑癌基因,还需要长时间观察。若这种治疗效果能在其他临床试验中复制,或可为CAR-T疗法带来很大改观。若真的只需一个细胞就起效,制备时间将大大缩短,药价也将不再是天文数字。
(编译 张亦凡)














