无转移生存作为前列腺癌新药审批的主要终点
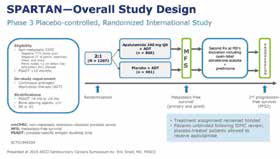
日前,《新英格兰医学杂志》刊发关于FDA对于前列腺癌临床研究终点设计的考量文章。文章指出,今年早些时候,FDA批准了雄激素受体抑制剂Apalutamide (阿帕鲁胺)用于治疗非转移性去势抵抗性前列腺癌(nmCRPC),这一批准基于SPARTAN研究结果,该随机安慰剂对照研究共纳入1207例患者,结果显示,Apalutamide治疗显著改善无转移生存(定义为从随机分组至影像学检出远处转移病变或死亡)。这是首个获批准用于非转移性CRPC的药物,也是第一次采用无转移生存作为主要终点来支持药物批准。
非转移性去势抵抗性前列腺癌尽管睾酮达去势水平,仍有PSA水平升高,影像学无远处转移。随着PSA筛查推广,多数前列腺癌患者无症状局部病变阶段即被检出,到检出PSA水平升高和出现转移或死亡可以有很多年,如此长的生存期加上有多重后续治疗可能带来混杂,采用总生存作为终点不切实际,人们致力于寻找更早期的疗效终点。
FDA多年前召开咨询委员会会议,讨论认为无转移生存是可用的终点,但要确保药物有临床获益,无转移生存改善需要非常显著且能通过风险获益评估。陆续有研究以无转移生存作为主要终点、或与总生存为共同终点或次要终点,包括SPARTAN研究还有评估恩杂鲁胺的PROSPER研究。
SPARTAN研究中,Apalutamide使中位无转移生存从16.2个月延长至40.5个月,至转移时间和无进展生存也有改善,总生存未达到,药物对总生存无不利影响,安全性也良好,FDA基于该研究结果予以批准。PROSPER研究中,恩杂鲁胺联合雄激素剥夺治疗使转移和死亡风险降低71%,延缓22个月的转移出现时间,FDA给予了优先审批。
无转移生存作为终点有一些挑战,终点评估是通过影像学检查,影像学检查敏感性会影响研究结果。是否将局部进展排除在不同研究中也不一致,也需考量这种进展对总体结果的影响。FDA批准Apalutamide后,使得在nmCRPC中开展安慰剂对照临床试验的难度增加,以活性药物为对照和叠加研究设计成为趋势,或者安全性类似的情况下,无转移生存改善依然可以获批,而对于不良反应较大的药物,需要无进展生存改善更显著。联合用药时获益要超过增加的毒性。
对转移性CRPC已常规采用影像学无进展生存作为主要终点,非转移CRPC也有了更早的疗效终点无转移生存。
在我国,国家药监局根据其2017年发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》制定的《临床急需药品有条件批准上市的技术指南》提出,对于临床急需药品,应用替代终点指标或中间临床终点指标的临床研究结果可预测该产品很可能具有疗效和临床获益的,应有条件批准上市。应该可以期待,不久的将来,阿帕鲁胺等药品也可以服务于中国的非转移性CRPC患者。(编译 张亦凡)