FDA批准第四款PARP抑制剂
美国FDA日前宣布批准辉瑞治疗HER2阴性局部晚期或转移性乳腺癌药物Talazoparib(TALZENNA),该药成为FDA批准的第四种ADP-核糖聚合酶 (PARP)抑制剂。同时FDA也批准Myriad Genetic公司的BRACAnalysis CDx伴随式诊断试剂盒,以鉴定乳腺癌患者是否为有害或可疑有害种系BRCA突变gBRCAm。(自FDA网站)
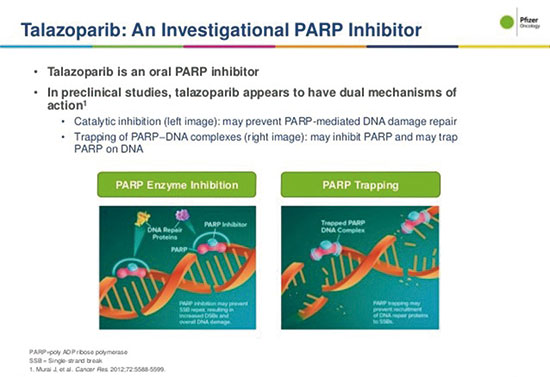
Talazoparib是辉瑞研发的创新PARP抑制剂,具有双重作用机制,它能够通过阻断PARP酶的活性和将PARP酶锁定在DNA损伤位点的方式诱导肿瘤细胞的死亡。临床前研究结果证实Talazoparib具有良好抑制肿瘤的能力。早先 Talazoparib也获得了美国FDA颁发优先审查的资格。
此次批准是基于EMBRACA研究(NCT01945775),该研究为开放标签试验,入组431例gBRCAm突变HER2阴性局部晚期或转移性乳腺癌患者,2:1比例随机分组分别接受Talazoparib (1 mg/d po) 或医生选择的化疗。
根据实体瘤反应评估标准(RECIST)1.1,主要疗效结果是无进展生存期(PFS),通过盲法独立中心评价进行评估。Talazoparib和化疗组的中位PFS分别为8.6个月和5.6个月(HR=0.54,95%CI 0.41~0.71, P<0.0001)。患者报告的生活质量分析显示,Talazoparib组总体健康状况恶化的时间延长24.3个月,化疗组为6.3个月。
该药有提示警惕骨髓增生异常综合征/急性髓性白血病、骨髓抑制等不良反应的发生,最常见不良反应包括疲劳、贫血、恶心、中性粒细胞减少、头痛、血小板减少、呕吐、脱发、腹泻、食欲减退等。
研究者表示,希望继续研究PARP抑制剂在其他BRCA突变乳腺癌患者中的应用,包括早期患者,以及在没有遗传性BRCA突变的患者中增强PARP抑制剂活性的可能性。
(编译 王娜)