DB-03研究中期分析发表 T-DXd对比T-DM1治疗HER2阳性晚期乳腺癌
DESTINY-Breast03研究中期分析结果在《新英格兰医学杂志》发表,该研究对德喜曲妥珠单抗(Trastuzumab deruxtecan,DS8201a,T-DXd)与T-DM1(恩美曲妥珠单抗)治疗HER2阳性晚期乳腺癌的有效性和安全性进行了比较。(N Engl J Med. 2022, 386: 1143-1154. DOI: 10.1056/NEJMoa2115022)
该研究在2021年ESMO年会上进行了报告,并改变了ESMO指南、ABC6指南共识及NCCN临床实践指南,为HER2阳性晚期乳腺癌的二线治疗提供了参考。2022年3月22日,T-DXd上市申请正式获得国家食品药品监督管理局(NMPA)受理。

DESTINY-Breast03为Ⅲ期、多中心、开放性、随机、阳性对照试验,评价在曲妥珠单抗和紫杉烷治疗期间或治疗后进展的HER2阳性晚期或转移性乳腺癌患者中,T-DXd和T-DM1的疗效和安全性。患者按1∶1比例随机分配接受T-DXd或T-DM1,根据激素受体状态(阳性或阴性)、既往帕妥珠单抗治疗和内脏疾病史进行分层。T-DXd每3周一次静脉给药,剂量为5.4 mg/kg,T-DM1每3周一次静脉给药,剂量为3.6 mg/kg。
2018年7月20日至2020年6月23日期间,15个国家169家研究中心入组共计524例HER2阳性转移性乳腺癌患者。261例患者被随机分配接受T-DXd,263例接受T-DM1。两组人口统计学和基线疾病特征相似。
T-DXd组和T-DM1组分别有130例(49.8%)和123例(46.8%)患者在转移性疾病背景下既往接受过一线治疗(不包括内分泌治疗),62.1%和60.1%的患者接受过帕妥珠单抗治疗,分别有62例(23.8%)和52例(19.8%)患者报告稳定的脑转移,中位随访持续时间分别为16.2个月和15.3个月。
根据盲态独立中心审查评估,T-DXd治疗在无进展生存期方面的获益优于T-DM1。T-DXd组未达到中位无进展生存期,T-DM1组的中位无进展生存期为6.8个月。第12个月时,根据盲态独立中心审查评估,T-DXd组和T-DM1组无疾病进展生存的患者百分比分别为75.8%和34.1%;疾病进展或任何原因死亡的风险比为0.28。研究者评估的T-DXd组的中位无进展生存期为25.1个月,T-DM1组为7.2个月(HR=0.26)。
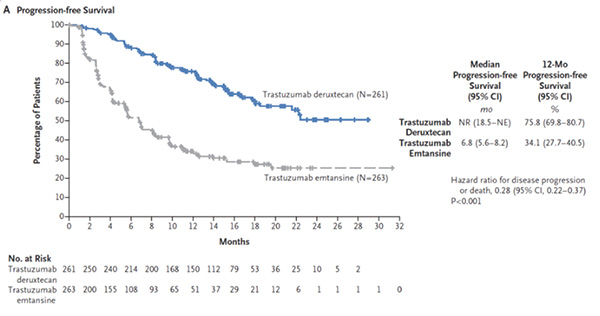
亚组分析显示,在所有亚组(包括根据既往治疗线数定义的亚组)中,T-DXd组无进展生存期(通过盲态独立中心审查评估)获益均优于T-DM1组。在既往未接受过一线或一线治疗的患者中,疾病进展或全因死亡风险比为0.33,在既往接受过二线或二线以上治疗的患者中,疾病进展或全因死亡的风险比为0.28。
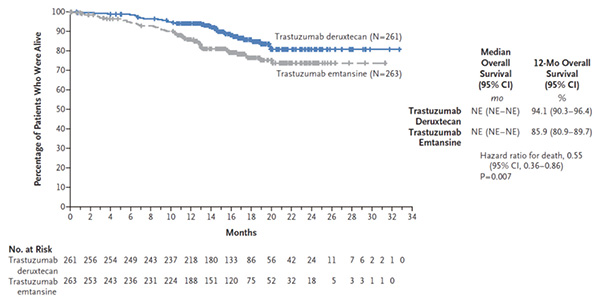
中期分析数据截止时,T-DXd组12个月时生存患者百分比为94.1%,T-DM1组为85.9%,差异未达到预先规定显著性临界值, 但生存期曲线的早期和持续分离显示T-DXd相对于T-DM1的总生存期获益趋势。截至数据截止日期,T-DXd组和T-DM1组分别有33例(12.6%)和53例(20.2%)患者死亡。
T-DXd组和T-DM1组总缓解率分别为79.7%和34.2%,完全缓解患者分别为42例(16.1%)和23例(8.7%)。几乎所有患者(96.6%)均通过T-DXd获得疾病控制。T-DXd组观察到完全缓解的患者几乎是T-DM1组的2倍(16.1% vs. 8.7%)。在接受T-DXd治疗的患者中,仅1.1%的患者为疾病进展,相比之下,接受T-DM1治疗的患者为17.5%。T-DXd的缓解通常较快,中位至缓解时间对应于治疗开始后计划的首次复查。
安全性方面,T-DXd组和T-DM1组的不良事件发生率相似(分别为99.6%和95.4%)。两组中≥3级不良事件发生率相似(分别为52.1%和48.3%)。除间质性肺病和肺炎外,两个治疗组中因不良事件而中止试验治疗的患者百分比相似。
数据表明,在既往接受过曲妥珠单抗和紫杉烷治疗的HER2阳性转移性乳腺癌患者中,T-DXd在降低疾病进展或死亡风险方面优效于T-DM1。对于既往接受过曲妥珠单抗和紫杉烷以及帕妥珠单抗(如可用)治疗的HER2阳性转移性乳腺癌患者,T-DXd是一种有效的新治疗方法。
(编译 于娜)