研究发现胃癌免疫治疗新靶点
中国香港中文大学于君教授等发现,YTHDF1在胃癌中过表达,并通过诱导肿瘤细胞增殖和抑制树突状细胞介导的抗肿瘤免疫反应促进胃癌进展。YTHDF1缺失可促进肿瘤细胞中干扰素受体1(IFNGR1)和JAK-STAT1信号通路过表达,从而增加抗肿瘤免疫的敏感性,YTHDF1有望成为胃癌免疫治疗新靶点。(J Immunother Cancer. 2022, 10: e003663. DOI: 10.1136/jitc-2021-003663)
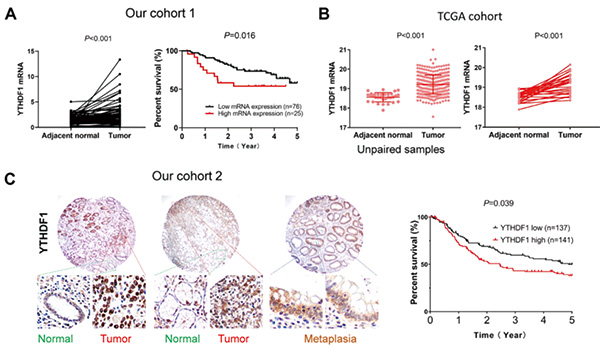
研究者收集2015~2018年在威尔士亲王医院确诊的胃癌患者组织样本101例组成队列1,用于检测YTHDF1 mRNA表达情况,收集1998~2006年确诊的胃癌患者组织样本278例组成队列2,用于检测YTHDF1蛋白表达水平。从TCGA数据库中选取胃癌患者肿瘤组织样本和癌旁正常组织样本(其中未配对组:癌旁正常组织32例,肿瘤组织375例;配对组:同一患者的肿瘤组织和癌旁正常组织各27例),分析胃癌患者肿瘤组织和癌旁正常组织中mRNA相关基因表达情况。
结果显示,无论是配对组还是在未配对组的肿瘤组织,均观察到YTHDF1表达上调现象。在威尔士亲王医院收集的队列1和队列2的胃癌患者组织样本中,YTHDF1 mRNA水平和YTHDF1蛋白水平在胃癌患者的肿瘤组织中均出现过表达。在队列1中,YTHDF1 高mRNA表达与胃癌患者的低生存率显著相关;多变量Cox回归分析中,YTHDF1 高mRNA表达是胃癌患者的独立不良预后因素。在队列2中,YTHDF1蛋白过表达与胃癌患者的低生存率相关。
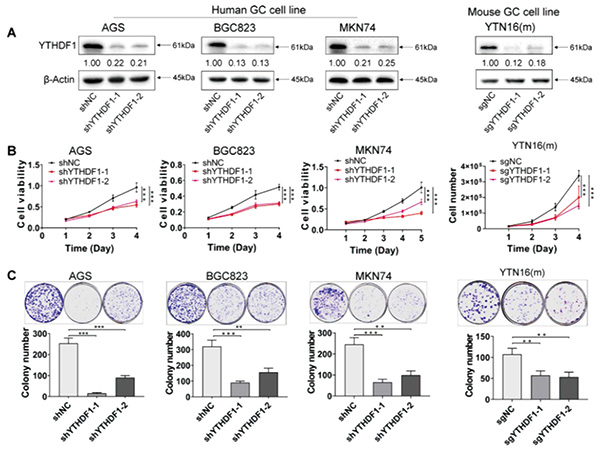
研究者检测了12种人胃癌细胞株中YTHDF1蛋白的表达情况,发现YTHDF1蛋白在三种人胃癌细胞系AGS、BGC823、MKN74中表达相对较高。研究者选取这三个细胞系进行YTHDF1基因敲降,发现YTHDF1敲降显著抑制AGS、BGC823、MKN74细胞增殖。对小鼠胃癌细胞系YTN16进行YTHDF1基因敲除,也观察到类似现象。功能试验显示,YTHDF1敲降/敲除可显著抑制人和小鼠胃癌细胞的增殖和集落形成能力。
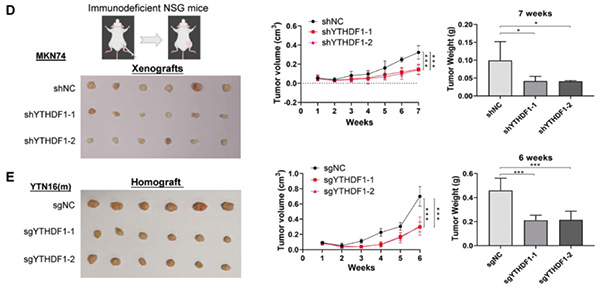
体外实验结果表明,YTHDF1有明显促癌作用。为了探索YTHDF1在体内是否也有同样的促癌作用,研究者分别将转染空白质粒的MKN74细胞(MKN74-shNC)和敲降YTHDF1表达的两个稳转细胞系MKN74-shYTHDF1-1和MKN74-shYTHDF1-2分别接种到小鼠皮下。
与接种MKN74-shNC的小鼠相比,接种MKN74-shYTHDF1-1和MKN74-shYTHDF1-2的小鼠,皮下肿瘤的大小和重量均明显减小。这在接种转染空白质粒的YTN16-sgNC细胞和YTHDF1基因敲除(YTN16-sgYTHDF1-1和YTN16-sgYTHDF1-2)细胞的小鼠中得到进一步验证。
体内外实验表明,YTHDF1可明显促进胃癌细胞增殖。RNA测序分析显示,在YTHDF1基因敲除细胞中,有575个基因表达上调,866个基因表达下调。基因富集分析揭示,YTHDF1基因敲除细胞中免疫调节途径基因的缺失,包括CTLA-4检查点通路和CD209 DC通路。使用KEGG数据库进行基因富集分析发现,在YTHDF1基因敲除细胞中JAK-STAT信号通路基因表达上调,T细胞受体信号通路基因表达下调,提示YTHDF1可能在体内发挥免疫调节作用。
研究者使用具有免疫活性的同源小鼠模型C57BL/6小鼠,在其皮下分别接种YTN16-sgNC细胞和YTHDF1基因敲除细胞。在整个持续6周的实验过程中,接种YTN16-sgNC细胞的小鼠肿瘤持续增长,接种YTHDF1基因敲除细胞的小鼠在接种1周后皮下虽均有肿瘤长出,但接种YTN16-sgYTHDF1-1的小鼠皮下肿瘤在2周后开始逐渐缩小,说明YTHDF1的促癌作用部分依赖于功能正常的免疫系统。
在C57BL/6小鼠身上分别接种YTN16-sgNC细胞和YTHDF1基因敲除细胞,在2周后收集肿瘤,通过流式细胞术检测肿瘤微环境中的免疫细胞浸润情况。与接种YTN16-sgNC细胞相比,接种YTHDF1基因敲除细胞的小鼠肿瘤大小和重量都有明显减少。流式细胞仪分析显示,YTHDF1基因敲除组的肿瘤组织中浸润性免疫细胞(CD45+细胞)比例明显高于YTN16-sgNC组。YTHDF1基因敲除组肿瘤组织中,CD3+细胞和CD45+细胞比例显著高于YTN16-sgNC组,且在浸润性免疫细胞中,CD4+T细胞和CD8+T细胞数量和占比也均高于YTN16-sgNC组。与YTN16-sgNC组肿瘤组织相比,YTHDF1基因敲除组肿瘤组织中的IFNγ显著升高。YTHDF1缺失使IFNGR1、JAK1、JAK2和STAT1蛋白表达上调。表明YTHDF1基因敲除使IFNGR1上调进一步激活JAK-STAT1通路,从而增强肿瘤免疫监视。肿瘤细胞中YTHDF1缺失可诱导成熟DC的募集,促进CD4+T细胞和CD8+T细胞的浸润,并增加细胞毒性细胞因子IL-12分泌。
该研究表明,YTHDF1在胃癌中过表达,并发挥促癌作用,YTHDF1缺失诱导DC细胞募集,增加MHCII表达和IL-12分泌,进而促进CD4+T和CD8+T细胞浸润,增加干扰素γ分泌;YTHDF1缺失介导肿瘤细胞中IFNGR1和JAK-STAT1信号通路过表达,这可能有助于恢复抗肿瘤免疫的敏感性,研究为胃癌的免疫治疗提供了一种新策略,YTHDF1或有望成为胃癌免疫治疗的新靶点。
(编译 张楠)


