靶向HER2/CD3×CD28的三特异性抗体研究
美国研究者Seung等研究发现靶向HER2和T细胞的HER2/CD3×CD28三特异性抗体,不仅可促进CD8+T细胞对乳腺癌细胞的杀伤,还能以CD4+T细胞依赖方式直接抑制肿瘤细胞分裂,达到抑制肿瘤生长的效果,CD4+T在辅助作用之外还具备直接抗肿瘤功能。(Nature. 2022, 603: 328-334. DOI: 10.1038/s41586-022-04439-0)
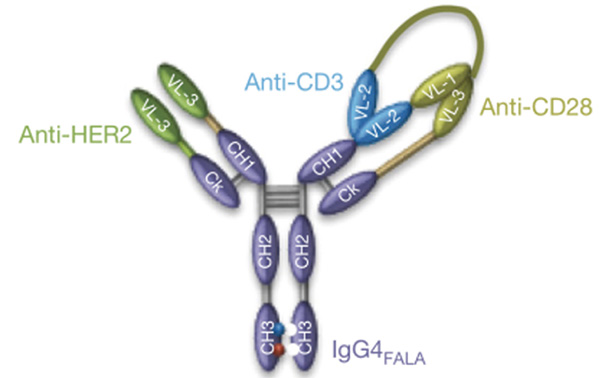
为探讨有效治疗HER2低表达肿瘤如三阴性乳腺癌对HER2疗法的耐药性,研究者尝试构建多特异性抗体,将T细胞引导至HER2+肿瘤细胞身旁,将T细胞激活,促进其对肿瘤细胞的杀伤。基于T细胞均表达CD3和CD28分子,研究者构建了HER2/CD3×CD28三特异性抗体。多特异性抗体是新兴肿瘤免疫治疗药物,通过人工设计使Y型抗体双臂分别靶向不同的抗原,使一个抗体能结合单个细胞或多个细胞上的不同抗原。多特异性抗体依靠阻断免疫抑制性受体,或将免疫细胞拉近肿瘤细胞并激活免疫细胞等机制发挥抗肿瘤作用。
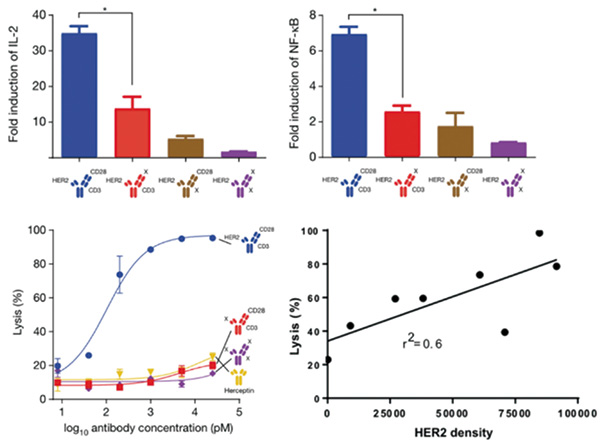
在体外测试中发现该抗体可刺激T细胞产生IL-2、激活NF-κB通路,并能介导T细胞以抗原特异性的方式杀伤HER2+肿瘤细胞。该抗体介导T细胞对肿瘤细胞的杀伤能力与肿瘤细胞上HER2的表达水平呈正相关。
为探讨该三特异性抗体在体内的治疗效果,研究者给荷瘤的重度免疫缺陷小鼠转输人原代T细胞,之后给予三特异性抗体治疗。发现不论HER2高表达肿瘤还是低表达肿瘤,在使用抗体治疗后肿瘤生长均被有效抑制,提示该抗体具有治疗HER2低表达肿瘤的潜力。
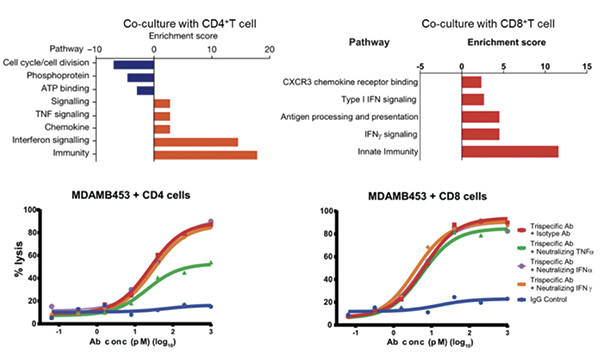
研究者分别向荷瘤小鼠转输了人CD3+混合T细胞、CD4+T细胞或CD8+T细胞,并使用三特异性抗体治疗。发现接受三特异性抗体治疗后,转输CD3+混合T细胞和CD4+T细胞的小鼠肿瘤几乎完全消失,仅有CD4+T存在的情况下,肿瘤生长完全被抑制。将CD4+T细胞与HER2+肿瘤细胞共培养24小时,在有三特异性抗体存在的情况下,CD4+T细胞有效抑制肿瘤细胞分裂,使肿瘤细胞的细胞周期停滞在G1/S期。提示CD4+T细胞可通过使肿瘤细胞细胞周期停滞的方式抑制肿瘤生长。三特异性抗体可通过不同但互补的机制,刺激CD4+T和CD8+T细胞抑制肿瘤生长。使用抗体中和TNF-α后,CD4+T细胞抑制肿瘤细胞生长的能力被极大削弱,但CD8+T细胞不被削弱,提示CD4+T细胞通过分泌TNF-α来抑制肿瘤细胞的细胞周期。
该研究构建了一种能诱导T细胞攻击HER2低表达肿瘤细胞的三特异性抗体,首次发现CD4+T细胞可通过直接抑制肿瘤细胞的细胞周期发挥抗肿瘤作用,这是一种新发现的抗肿瘤免疫机制,提示针对CD4+T细胞作用开发同时提高CD4+T细胞和CD8+T细胞抗肿瘤活性药物或有更好的治疗效果。 (编译 张楠)


