多线治疗失败的、铂耐药或铂难治性卵巢癌 Olvi-Vec后铂基化疗联合或不联合贝伐珠单抗均安全有效
美国AdventHealth癌症研究所Holloway等报告的Ⅱ期非随机临床试验显示,olvimulogene nannivacirepvec(Olvi-Vec)后铂基化疗联合或不联合贝伐珠单抗作为免疫化疗,在铂耐药或铂难治性卵巢癌(PRROC)患者中显示出良好的客观缓解率(ORR)和无进展生存期(PFS),并且具有可控的安全性。这些结果值得在确认性的Ⅲ期试验中进一步评估。(JAMA Oncol. 2023年5月25日在线版)
PRROC患者的治疗选择有限,这也意味着有相当大的未被满足的医疗需求。该研究的目的是评价腹腔注射Olvi-Vec病毒治疗和铂基化疗联合或不联合贝伐珠单抗治疗PRROC患者的抗肿瘤活性和安全性。
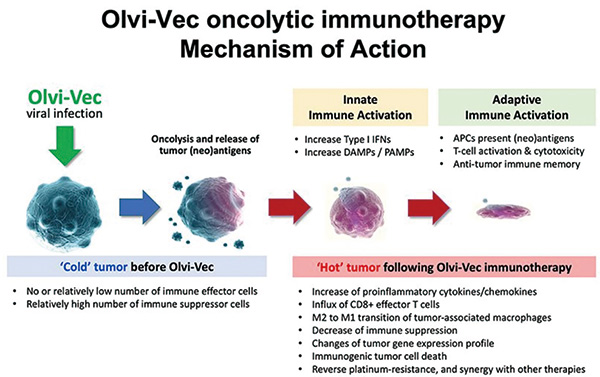
这项开放标签、非随机、多中心的Ⅱ期临床试验(VIRO-15)招募了2016年9月至2019年9月最后一次既往治疗后出现疾病进展的PRROC患者。数据截止日期为2022年3月31日,分析时间为2022年4月至2022年9月。
患者的Olvi-Vec通过临时腹腔注射透析导管连续2天每日给药(3×109 pfu/d),随后接受含铂双药化疗加或不加贝伐珠单抗。
主要终点是通过实体瘤反应评价标准1.1版(RECIST 1.1)和癌症抗原125(CA-125)来评估ORR和PFS。次要终点包括缓解持续时间(DOR)、疾病控制率(DCR)、安全性和总生存期(OS)。
结果纳入了27例多线治疗失败的铂耐药(14例)或铂难治(13例)卵巢癌患者。中位年龄为62岁(35~78岁)。既往治疗的中位数为4(2~9)。所有患者均完成了Olvi-Vec输注和化疗。中位随访时间为47.0个月(95%CI 35.9个月~NA)。
总体而言,RECIST 1.1评估的ORR为54%(95%CI 33%~74%),DOR为7.6个月(95%CI 3.7~9.6个月)。DCR为88%(21/24)。CA-125评估的ORR为85%(95%CI 65%~96%)。RECIST 1.1评估的中位PFS为11.0个月(95%CI 6.7~13.0个月),6个月的PFS率为77%。
铂耐药组的中位PFS为10.0个月(95%CI 6.4个月~NA),铂难治组的中位PFS为11.4个月(95%CI 4.3~13.2个月)。所有患者的中位OS为15.7个月(95%CI 12.3~23.8个月),铂耐药组的中位OS为18.5个月(95%CI 11.3~23.8个月),铂耐药组的中位OS为14.7个月(95%CI 10.8~33.6个月)。
最常见的治疗相关不良事件(TRAE:任何级别和3级)是发热(分别为63.0%和3.7%)和腹痛(分别为51.9%和7.4%)。未出现4级TRAE,也未出现治疗相关的中断或死亡。
(编译 昌婉瑞)


