FDA加速批准Lifileucel治疗不可切除或转移性黑色素瘤
近期,美国食品与药物管理局(FDA)加速批准了Lifileucel(Amtagvi),这是一种肿瘤来源的自体T细胞免疫疗法。其获批的适应证有二:一是接受过PD-1阻断抗体治疗的、不可切除或转移性的、成年黑色素瘤患者;二是BRAF抑制剂联合或不联合MEK抑制剂经治的、BRAF V600突变阳性的、不可切除或转移性的、成年黑色素瘤患者。
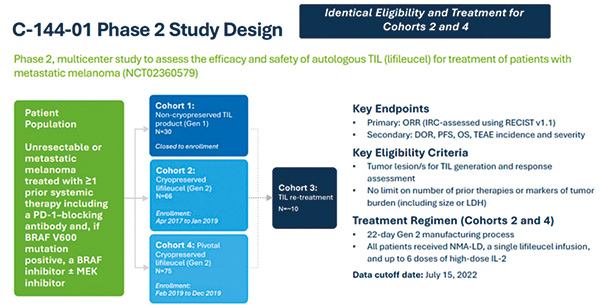
全球、多中心、多队列、开放标签、单组C-144-01试验评估了肿瘤来源的自体T细胞免疫疗法安全性和有效性,入组不可切除或转移性黑色素瘤患者(接受过至少一种全身治疗,包括PD-1阻断抗体),或BRAF抑制剂联合或不联合MEK抑制剂治疗过的、BRAF V600突变阳性的患者。89例患者中,2例患者因制备产品未达到技术规格被排除,5例患者因产品特异性不足而被排除。
患者接受环磷酰胺、美司钠、氟达拉滨的预处理方案清除淋巴细胞;然后输注制备好的Lifileucel。期间,输注后3~24小时,患者接受每8~12小时60万IU/kg剂量的IL-2(白介素),共6剂,以支持体内细胞扩增。Lifileucel的中位给药剂量为21.1 × 109个活细胞。
主要疗效观察指标为客观缓解率和缓解持续时间。至对Lifileucel产生初始应答的中位时间为1.5个月。基于73例受试者接受推荐剂量范围(7.5 ×109至72×109个活细胞)内的Lifileucel,客观缓解率为31.5%(95%CI 21.1%~43.4%),中位缓解持续时间未达到(95%CI 4.1个月~未达到)。
Lifileucel的处方信息包含黑框警告的治疗相关死亡率、延长的严重细胞减少症、严重感染、心肺和肾脏损害。最常见的不良反应(发生率≥20%)依次为寒战、发热、乏力、心动过速、腹泻、发热性中性粒细胞减少、水肿、皮疹性低血压、脱发、感染、缺氧和呼吸困难。
(编译 刘丹)


