HR+ HER2-转移性乳腺癌内分泌治疗ASCO指南更新
美国Dana-Farber癌症研究所的Burstein等针对激素受体阳性、人表皮生长因子受体2(HER2)阴性的转移性乳腺癌(MBC)患者,进行了有针对性的电子文献检索,以确定包括该患者群体的任何其他随机对照试验,最终有了新的治疗选择,包括新型内分泌治疗和靶向治疗,其治疗方法遵循基因组生物标志物检测结果的指导。(J Clin Oncol. 2024年3月13日在线版)
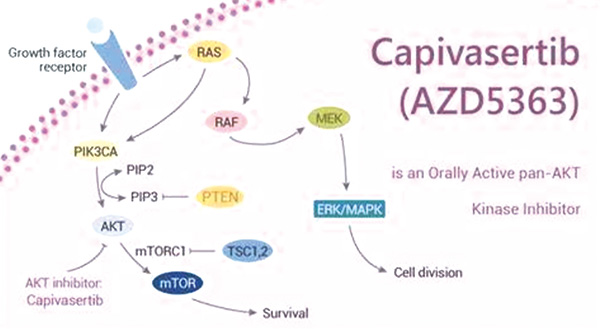
CAPItello-291 Ⅲ期双盲随机对照试验(RCT)评估了氟维司群联合AKT通路抑制剂Capivasertib的疗效,随后美国食品与药物监督管理局(FDA)于2023年11月16日批准了Capivasertib及其配套的诊断设备。
证据审查
CAPItello-291试验纳入708例绝经前/围绝经期/绝经的女性患者或男性患者,均为激素受体阳性、HER2阴性的局部晚期或转移性乳腺癌患者,然后随机分配到Capivasertib+氟维司群组(355例)或安慰剂+氟维司群组(353例)。
患者在既往的芳香酶抑制剂治疗期间经历了疾病进展或复发,联合或不联合CDK4/6抑制剂。Capivasertib的给药方案为:400 mg,每天口服两次,连续4天,然后每周休息3天。所有患者的肿瘤组织接受二代测序。
PIK3CA和AKT1的激活突变和PTEN基因的失活变化在除中国(使用OncoScreen Plus)外的所有国家都通过FoundationOneCDx集中检测。既往的CDK4/6暴露被用于分层分析。无进展生存期(PFS)为双重主要终点,分别在所有患者(477例)中以及PIK3CA/AKT1/PTEN改变肿瘤的患者(289例)中进行评估。
Capivasertib+氟维司群组的中位PFS为7.2个月,安慰剂+氟维司群组的中位PFS为3.6个月(HR=0.60,P<0.001)。在PIK3CA/AKT1/PTEN改变的肿瘤人群中,Capivasertib+氟维司群组的中位PFS为7.3个月,安慰剂+氟维司群组的为3.1个月(HR=0.50,P<0.001)。
在AKT通路未改变的肿瘤患者中,联合Capivasertib治疗和联合安慰剂治疗的中位PFS分别为5.3个月和3.7个月(HR=0.79,P值无统计学意义),表明当肿瘤中存在AKT通路突变时患者获益最大。Capivasertib+氟维司群可改善PFS,与既往是否暴露于CDK4/6无关。
患者报告的生活质量结果显示,两组的总体健康状况(GHS)与基线一致,除了Capivasertib+氟维司群组腹泻加重外,功能或症状量表评分没有有临床意义的变化。Capivasertib使GHS至恶化的时间更长;除腹泻外,联合Capivasertib的至功能恶化时间和至症状恶化时间也均有数值上的延长。
医生报告的≥3级不良事件(AE)在Capivasertib+氟维司群组中更常见,包括皮疹(对比安慰剂+氟维司群组:12.1% vs. 0.3%)、腹泻(9.3% vs. 0.3%)和高血糖(2.3% vs. 0.3%),AE更频繁地导致治疗中断(13% vs. 2.3%)。
类似地,FAKTION研究是一项随机对照的Ⅱ期研究,对比了氟维司群联合Capivasertib或联合安慰剂,结果与CAPItello-291相似,但获益仅限于PIK3CA/AKT1/PTEN改变的肿瘤患者。
更新建议
专家小组推荐多线内分泌治疗(ET),常与靶向药物配对使用,根据既往治疗和ESR1、PIK3CA或AKT1激活突变或PTEN失活的常规测试进行选择。专家小组建议将CDK4/6抑制剂治疗与ET纳入一线治疗。二线和三线疗法反映了基于肿瘤基因组学的靶向选择。
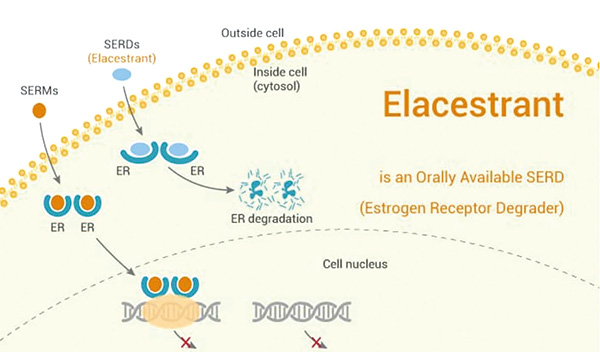
ET联合AKT通路抑制剂Capivasertib适用于PIK3CA或AKT1突变或PTEN失活的肿瘤,而ET联合PI3激酶抑制剂Alpelisib适用于PIK3CA突变但AKT1未突变的肿瘤。其他选择包括以哺乳动物雷帕霉素抑制剂依维莫司为靶点的ET,与肿瘤基因组学无关。口服选择性雌激素受体降解剂Elacestrant的单药治疗是ESR1突变肿瘤的一种选择(证据质量:高;推荐强度:强)。
对于那些有可能接受Capivasertib或Alpelisib治疗的候选患者,没有对比PIK3CA靶向疗法的疗效数据。对于这类患者,专家组建议根据感知到的风险—获益因素(如高血糖、腹泻或AE的停药治疗)选择靶向药物(证据质量:低;推荐强度:弱)。
(编译 赵璐)