研究发现逆转细胞周期可使癌细胞遗传物质出错
美国约翰斯·霍普金斯大学McKenney等研究发现一条全新的通路可以逆转细胞周期,让部分细胞经历第二轮DNA复制,导致染色体倍增。(Science. 2024年5月3日在线版)
细胞分裂是周而复始的精密过程,一个完整的细胞周期中,细胞经历DNA复制后,再通过有丝分裂将遗传物质平均分配到两个子代细胞中,确保遗传的稳定性。而35%~40%的肿瘤在进化过程中经历了染色体倍增,这种异常现象与癌症转移及更差预后相关,这种状态是如何形成的?
完成DNA复制后,若遭受应激,细胞可能会进入休眠状态,被免疫系统识别为缺陷细胞并清除。但随着年龄增长,免疫系统可能会无法再清除细胞。这时体内的异常细胞可以再次复制DNA,在下一次分裂时出现产生染色体倍增的子代细胞。
为了找到细胞周期中出错的原因,研究者选择了乳腺导管和肺组织的人类细胞进行研究,这些细胞有着更快的分裂速度,因此更适合进行可视化的观测。研究者开发了全新的生物传感器,能对单个细胞的活动进行检测,以找到那些DNA复制异常的细胞。这种生物传感器标记的,是在细胞周期调控中发挥核心作用的细胞周期蛋白依赖性激酶(CDK)。
此前研究发现,CDK家族部分成员(CDK4/6)会阻止细胞周期由G1期进入S期,多款基于这一机制激活抗肿瘤免疫的CDK4/6抑制剂已获批进入临床应用。最新研究发现除了在G1期向S期转变的过程之外,这些酶还在细胞周期的其他阶段发挥作用。
通常而言,一旦S期开启,细胞周期就进入不可逆的过程。然而最新研究却发现,在化学药物、紫外线辐射等环境应激作用下,G2期细胞的CDK4和CDK6活性下降;5~6个小时后,当细胞准备进入分裂期时,CDK2也受到抑制。
这时,其中一部分细胞会从G2期退出,再次进入G1期。之后当应激消失,这些已完成了DNA复制的细胞重新开始细胞周期,进行第二次DNA复制,最终分裂生成的子细胞就变成染色体翻倍的四倍体。
研究进一步发现,丝裂原活化蛋白激酶(MAPK)和应激活化蛋白激酶(SAPK)导致了细胞大量退出G2期。此外在具体机制上,G2期细胞的“逆转周期”是通过后期促进复合物(anaphase promoting complex,APC)在G2期的过早激活来实现。
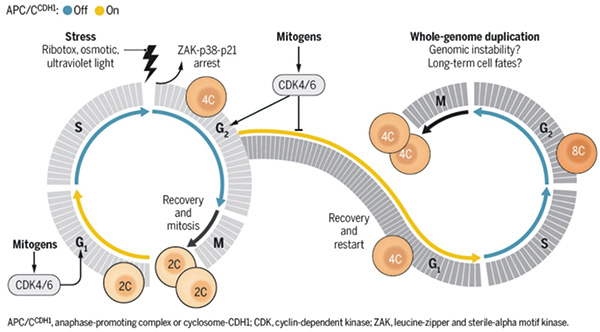
这项研究首次揭示,CDK4/6活性在G1至S期转换之外,还导致了细胞退出G2期和第二轮DNA复制。这些结果可能会导致CDK抑制剂诱导癌细胞再次进行DNA复制,最终产生耐药性或影响治疗效果。未来研究或许将找到避免APC过早激活的药物,从而阻止癌细胞再次复制其基因组。
该研究证实在缺乏p53的细胞中,细胞退出G2期的过程可通过SAPK的激活发生。这些发现改变了我们对细胞周期的理解,并且解释了染色体倍增在癌症中的高频率。考虑到SAPK信号在衰老相关应激反应中的作用,最新机制还可能成为衰老和肿瘤发生过程中遗传不稳定性的重要来源。 (编译 张嘉佳)


