研究发现2型免疫反应增强抗肿瘤免疫
美国耶鲁大学樊荣等在分析接受CAR-T治疗后B细胞急性淋巴白血病(B-ALL)持续缓解超8年患者的T细胞情况之后,意外发现CAR-T细胞的2型功能增强,与B-ALL患者病情超长期缓解密切相关,而且2型细胞因子IL-4能缓解CAR-T细胞的功能障碍。洛桑联邦理工学院唐力等研究发现,2型细胞因子Fc–IL-4能直接作用于肿瘤内终末耗竭CD8阳性T细胞,导致终末耗竭CD8阳性T细胞的糖酵解水平升高、生存率提升、效应功能增强。两项研究得出一个出人意料的结论:2型免疫反应能增强抗肿瘤免疫。(Nature.2024年9月25日在线版)
传统观点认为,2型细胞因子激发的2型免疫反应具有免疫抑制性,是促进癌症进展的。这两项研究发现颠覆了以往的认知,有望为肿瘤免疫治疗开创新局面。
CAR-T疗法在血液系统肿瘤治疗中已经创造了传奇,但与那些获得持久缓解的幸运急性淋巴白血病(ALL)患者相比,约50%的ALL患者会在CAR-T治疗后的一年内复发。目前对哪些患者会获得持久缓解哪些会短期内复发,学界还知之甚少,于是开始探讨长期缓解患者体内的CAR-T细胞情况。
研究1
CAR-T细胞疗法需要先从患者的身体里分离出一种叫做T细胞的免疫细胞,然后在体外对其进行基因改造,给这些细胞“装上”识别癌细胞的嵌合抗原受体,然后把改造后的细胞输回患者体内。在当年的CAR-T细胞治疗ALL的临床试验中,基因改造后的CAR-T细胞大部分被输回了患者体内,但有一小部分被保存下来用于研究分析。
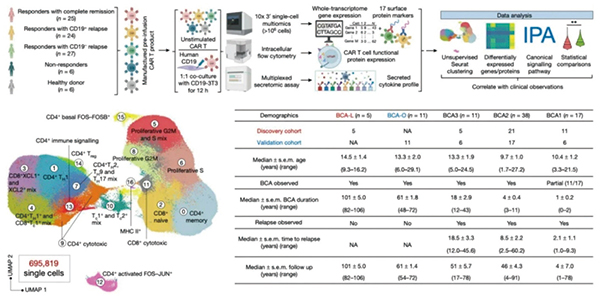
樊荣自2006年以来一直致力于开发单细胞分析技术,研究的临床样本,来自两项开创性临床试验。研究者对采集自82例白血病患儿的100多万个CAR-T细胞,进行了单细胞多组学测序,并创建了一份基因表达图谱。在这82例患儿中,有5例的病情缓解时间超过了8年。
根据这份独特的图谱,研究者发现,长期完全缓解的ALL患者(平均维持8.4年无复发缓解)确有特殊之处:其CAR-T细胞表现出更强的2型免疫反应特征,分泌的多种2型细胞因子显著更高。
研究结果显示,CAR-T细胞的2型功能升高(IL4、IL5、IL13和GATA3表达水平增加),与患者持续缓解时间较长显著相关。2型功能增强的细胞能调节功能障碍CAR-T细胞亚群,以维持整个CAR-T细胞群体的平衡。研究还发现,若在抗原特异性激活过程中加入IL-4,能缓解CAR-T细胞的功能障碍,同时在转录组和表观组水平上增强CAR-T细胞的适应性。
基于血清的蛋白质组学分析表明,持续5年或8年无复发的患者,其血液中2型细胞因子(IL-4和IL-13)水平较高。研究者随后在白血病小鼠模型中验证了2型功能高的CAR-T细胞的效果,发现它们有很强的增殖能力(比2型功能低的CAR-T细胞强10倍)和抗肿瘤活性。
研究者还发现,那些2型功能低的CAR-T细胞还可以被IL-4拯救。在CAR-T细胞制作的过程中加入IL-4,或在输注前用IL-4处理CAR-T细胞,均可增强2型功能低CAR-T细胞的功能,提升它们的抗肿瘤活性。
这些研究结果出乎研究者意料。传统认为CAR-T细胞疗法主要是以1型免疫反应为中心,而2型免疫反应主要介导抗寄生虫免疫以及哮喘、湿疹等过敏性反应,通常被认为在对抗癌细胞方面不起作用。典型2型细胞因子如白细胞介素4(IL-4)甚至被认为有促进肿瘤生长的作用。该研究结果却提示,增强CAR-T细胞的2型免疫功能可以提高CAR-T细胞的抗肿瘤活性。
研究2
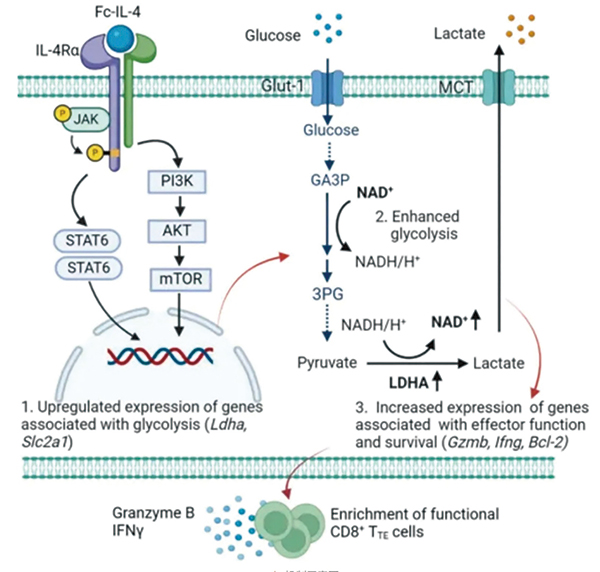
近年来已陆续有研究发现2型免疫反应有潜在的抗肿瘤作用,2型免疫功能的缺失与白血病复发有关。不过对于2型免疫如何调节或参与抗肿瘤免疫知之甚少。唐力等从2型细胞因子IL-4切入进行研究,从机制上探讨了2型免疫反应为何能增强免疫疗法的效果。研究者通过临床前动物模型发现,使用一种经过改良的2型细胞因子IL-4融合蛋白(Fc-IL-4)可以增强CAR-T疗法或免疫检查点阻断剂的效果,提高肿瘤小鼠的治愈率。实验结果显示,Fc-IL-4能直接作用于肿瘤内的CD8 T细胞,调节其代谢,帮助耗竭的T细胞补充能量,从而恢复它们的抗肿瘤活性。表明2型免疫可用来增强现有的免疫疗法,推动开发下一代癌症免疫疗法。
研究者构建了半衰期更长,活性与IL-4相当的重组融合蛋白Fc–IL-4。将Fc–IL-4注射到荷瘤小鼠体内之后,发现肿瘤内免疫细胞确实变多了,尤其是终末耗竭的CD8阳性T细胞(TTE),增加了近8倍(特别是抗原特异性的TTE细胞)。
从转录组水平看,Fc–IL-4处理还会导致TTE细胞中Ifng和Gzmb的表达显著增加;此外,包括1型细胞因子、细胞毒性和颗粒酶功能模块相关的基因表达水平也增加。
研究者探究Fc–IL-4究竟能不能增强过继免疫细胞疗法和免疫检查点抑制剂的抗肿瘤效果。Fc–IL-4与细胞免疫疗法联用,可大幅提升治疗效果。在单独使用细胞免疫疗法不能让肿瘤完全缓解的情况下,二者联合可让不同肿瘤小鼠模型实现60%,甚至是100%的完全缓解。即使使用相同的肿瘤再次挑战,二者联合仍有非常强大的抗肿瘤效果。Fc–IL-4联合免疫检查点抑制剂,也能达到非常好的抗肿瘤效果,而且没有显著的毒性反应。基于人类癌细胞系和人源化Fc–IL-4,也得到了类似的效果。
研究者对2型细胞因子Fc–IL-4增强抗肿瘤免疫的机制进行了探讨,发现Fc-IL-4通过IL-4Rα直接靶向肿瘤浸润CD8阳性TTE细胞,通过激活STAT6和PI3K-AKT-mTOR信号轴,以乳酸脱氢酶A(LDHA)依赖的方式,增强CD8阳性TTE细胞的糖酵解和NAD+水平,进而提升CD8阳性TTE细胞的存活率和效应功能。
这两项研究证实了2型细胞因子的抗肿瘤作用,揭示了背后的潜在分子机制,刷新了我们对2型细胞因子和2型免疫反应的认知。这两项研究成果有望重塑癌症免疫治疗,进一步提升细胞免疫疗法和免疫检查点抑制剂的疗效。 (编译 张俊熙)


