研究发现IL-27可助力免疫疗法
美国研究者Bréart等报告的研究显示,白介素-27(IL-27)可帮助CD8+细胞毒性T细胞(CTL)维持代谢适能性和细胞毒性功能,使其在肿瘤微环境中保持抗肿瘤战斗力,激活相应受体可使IL-27发挥作用与现有免疫疗法协同增效。(Nature. 2025年2月5日在线版)
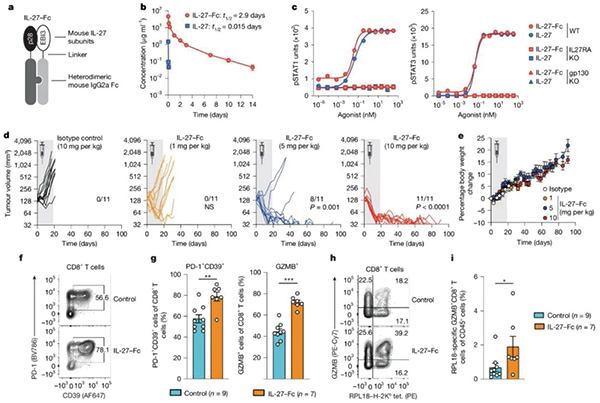
IL-27是IL6/IL-12细胞因子家族成员之一,细胞因子可对T细胞和抗肿瘤免疫带来影响。既往研究证实,IL-27可作用于CD4 +T 细胞,通过助力TH1型CD4 +T细胞分化等正向调控免疫应答,不过IL-27对CD8+细胞毒性T细胞影响尚不清楚。
研究团队基于TCGA数据库中皮肤黑色素瘤(免疫原性较强)资料及肿瘤模型小鼠RNA测序数据,分析了细胞毒性T细胞标志性基因(如GZMA/B/H等)的表达特征与各类细胞因子编码基因表达水平相关性,发现细胞毒性T细胞基因表达特征与IL-27两个亚基的编码基因即IL27和EBI3表达水平呈强相关,提示IL-27可能在细胞毒性T细胞功能调控中发挥重要作用,该结论可外推到不同实体瘤。
测序数据表明,肿瘤微环境中的IL-27仅由髓系细胞产生,表达相应受体IL-27R的限于T细胞和NK细胞。IL-27与受体结合后,激活其内部的STAT1和STAT3信号通路,上调多个细胞毒性和细胞增殖相关基因的表达,使细胞毒性T细胞处于高战斗力和高速增殖的状态,能高效识别和杀死肿瘤细胞;维持快速增殖状态对维持肿瘤微环境中的细胞毒性T细胞数量非常重要,只有足够的细胞毒性T细胞才能有效对抗肿瘤;同时增强其糖酵解和氧化磷酸化能力,为其提供能量供应。
研究发现,对荷瘤小鼠使用IL-27中和性抗体,可使肿瘤加速生长,瘤内浸润的CD8+细胞毒性T细胞显著减少,细胞毒性标志物表达水平和增殖速率显著下降。IL-27与PD-L1抑制剂联合使用可产生协同增效,小鼠实验中,注射编码IL-27的重组表达质粒来激活IL-27R,联合PD-L1抑制剂使用较单独使用IL-27或PD-L1抑制剂可更显著抑制肿瘤生长。
由于细胞因子在体内会被快速清除,直接使用IL-27本体用于临床治疗可能难以达到理想效果。研究者开发了一种与IL-27作用相似但半衰期延长200倍的异二聚体蛋白IL-27-Fc,这种蛋白由IL-27的两个亚基与IgG2a Fc片段融合而成,IL-27-Fc能与IL-27一样帮助CD8+ 细胞毒性T细胞维持高战力和高速增殖状态,对荷瘤小鼠发挥相似的抗肿瘤效果。
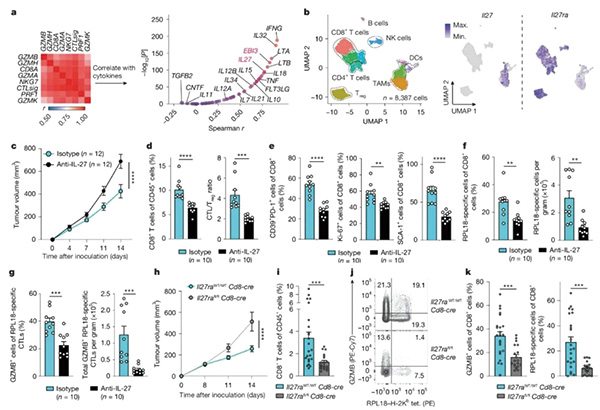
研究团队分析了多项临床试验数据,发现接受PD-L1抑制剂单药治疗的晚期肺癌(OAK研究)和尿路上皮癌患者研究(IMvigor210/211研究)中,IL27和EBI3基因高表达与患者对免疫疗法应答良好和预后良好相关,提示IL-27可作为筛选适合免疫疗法患者人群的标志物。
(编译 张瑞轩)


