FDA批准Apalutamide治疗非转移性前列腺癌
日前,美国FDA批准了Apalutamide(Erleada, Janssen)治疗有高疾病播散风险的去势抵抗性非转移性前列腺癌,这是FDA批准的第一种治疗非转移性去势抵抗性前列腺癌的药物。(自FDA网站)
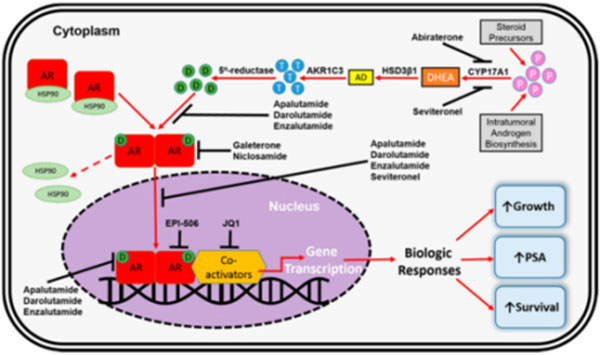
这也是第一次FDA用无转移生存作为其决策的主要终点。在Apalutamide获批的这一适应证基于的临床研究中,Apalutamide显示可带来显著的无转移生存的改善。Apalutamide是一种口服雄激素受体抑制剂。这一批准基于的是SPARTAN研究的安全性和疗效结果。研究入组806例患者,随机分入Apalutamide组(405例,240 mg/d)和安慰剂组(401例),所有患者接受内分泌治疗,促性腺激素释放激素类似物治疗或手术去势。所有患者此前接受了手术或放疗,即使接受了内分泌治疗,PSA评分10个月内翻倍。
主要研究终点,Apalutamide组较对照组有显著改善(40.5个月 vs. 16.2个月,P<0.001),转移或死亡风险降低72%(HR=0.28,95%CI 0.23~0.35)。Apalutamide组所有次要终点包括至转移时间、无进展生存、至症状改善时间等皆显著长于对照组。中位随访203个月。
该研究数据在刚刚结束的泌尿系统肿瘤研讨会(GUCS 2018)上进行了报告,同时在《新英格兰医学杂志》上进行了刊载。该研究结果提示,Apalutamide应作为高危非转移性去势抵抗性前列腺癌患者的新的标准治疗。
该研究中,因不良反应停止治疗率,Apalutamide组和对照组分别为10.6%和7.0%。Apalutamide组三种不良反应发生率高于对照组,分别为皮疹(23.8% vs. 5.5%)、甲减(8.1% vs. 2.0%)和骨折(11.7% vs. 6.5%)。
两组都可以保持基线生活质量评分,Apalutamide治疗组无生活质量减低,两组严重不良反应发生率无显著差异。过去,非转移性去势抵抗性前列腺癌无标准治疗,患者通常接受监测。
上周的GUCS会上报告的两项研究SPARTAN研究和PROSPER研究,都是针对这一患者人群,不过用的是不一样的雄激素受体抑制剂。这些研究旨在满足这类人群的临床需求,这类患者人群目前通常只能接受监测。报告的研究结果将改观治疗现状,延长至转移时间,最终可能有延长生存的作用。
根据美国国立癌症研究所数据,约10%~20%的早期前列腺癌为去势抵抗性前列腺癌,16%的患者诊断时无转移。未来随着比CT和骨扫描更先进的可更早检出转移的影像学技术的应用,非转移性去势抵抗性前列腺癌的例数将有所减少。新的可更早检出转移的技术的应用后,检出转移的患者就可以接受已获批的用于转移性前列腺癌的药物治疗了。
(编译 孙菲菲)


