首个宫颈癌PD-1免疫疗法获批
日前获,美国FDA批准默沙东公司Pembrolizumab(派姆单抗,Keytruda)治疗化疗期间或化疗后疾病进展的经FDA批准的检测试剂盒检测为肿瘤表达PD-L1(综合阳性评分CPS≥1)的复发或转移性宫颈癌患者,Pembrolizumab成为首个获批用于宫颈癌治疗的PD-1免疫疗法。(自FDA)
此次批准基于KEYNOTE 158研究(NCT02628067) 队列E中98例复发或转移性宫颈癌患者研究结果,该研究为多中心非随机开放标签多队列研究。患者接受Pembrolizumab(200 mg iv 每3周)治疗直至出现不可耐受毒性反应或疾病进展。77例PD-L1 CPS≥1,接受过至少一线化疗。PD-L1表达状态用PD-L1 IHC 22C3 pharmDx Kit进行检测。
主要疗效指标是客观缓解率,根据RECIST 1.1标准进行评价,以及缓解持续时间。中位随访11.7个月,患者客观缓解率为14.3%,完全缓解率为2.6%,部分缓解率为11.7%。基于11例患者估计的中位缓解持续时间为未达到,91%的患者缓解持续时间≥6个月。
98例患者中,不良反应导致的停药率为8%,39%的患者出现严重不良反应,最常见的严重不良反应(发生率≥20%)包括:贫血(7%),瘘管、出血和感染(尿路感染除外,均为4.1%)。最常见的不良反应(发生率≥20%)包括:疲劳(43%)、肌肉骨骼疼痛(27%)、腹泻(23%)、疼痛和腹痛(均为22%)和食欲下降(21%)。
基于肿瘤缓解率和缓解持续时间,Pembrolizumab获得FDA的加速批准,进一步的完全批准,将取决于确证性研究中临床受益的进一步验证。
值得一提的是,此次批准,使Pembrolizumab成为获批治疗晚期宫颈癌的首个PD-1免疫疗法,将为这类患者群体提供新的二线治疗选择。同时,此次批准也标志着Pembrolizumab在妇科肿瘤领域获得首个适应证批准。
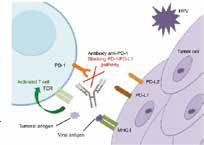
Pembrolizumab是一种人源化单克隆抗体,靶向阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞,增强免疫系统侦察和对抗肿瘤细胞的能力。目前,默沙东正在开展行业最大规模的免疫肿瘤学临床项目,涉及超过750个临床试验,治疗各种类型肿瘤。
(编译 王微微)