研究开发携带PD-1抗体的CAR-T
肿瘤免疫疗法两大主力无疑为免疫检查点抑制剂和CAR-T,但两种免疫疗法都有不尽如人意之处,CAR-T在血液系统肿瘤治疗颇有建树,但实体瘤治疗方面还差强人意,而免疫检查点抑制剂可增强免疫系统功能,在治疗实体瘤上颇有成效,但会带来严重的免疫相关不良反应,二者能否联合呢?
美国纪念斯隆凯特琳癌症中心研究者成功地使得二代CAR-T细胞分泌PD-1抗体单链可变区片段(scFv),同时提高自身和肿瘤环境中T细胞的抗癌活性,抗肿瘤治疗效果甚至比CAR-T联合PD-1抗体的治疗效果更好。这些scFv局限分泌在肿瘤附近,基本不进入血液循环,令CAR-T抗肿瘤活性更高更持久的同时,保证了较低的副作用。(Nat Biotechnol. 2018 年8月13日在线版. doi: 10.1038/nbt.4195)
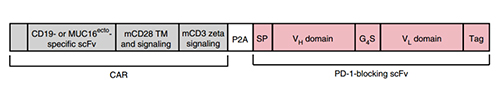
结合CAR-T和免疫检查点抑制剂并不容易,细胞上添加额外蛋白直接加PD-1抗体比较困难,于是研究者选择了PD-1抗体可变区的片段,类似迷你PD-1抗体,也可很好地结合PD-1,避免肿瘤细胞逃脱T细胞的免疫监视。
研究者首先构建了小鼠用的这种装甲CAR-T,选择了CD19和MUC16两种肿瘤特异性抗原(前者常出现于血液系统肿瘤中,后者是卵巢癌和胰腺癌的分子标志),结合小鼠CD28和CD3zeta,成功制成两种CAR-T细胞19m28mZ和4H11m28mZ,并加上了挑选出的scFv——RMP1-14。
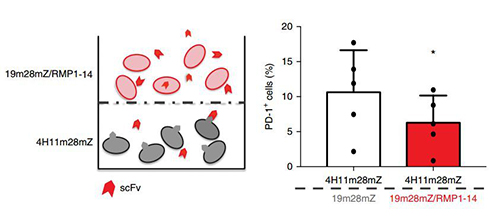
研究者在小鼠卵巢癌模型中尝试了这两种装甲CAR-T,同时对比了普通CAR-T联合直接注射scFv的组合疗法,发现装甲CAR-T的治疗效果优于单独使用普通CAR-T,与CAR-T联合scFv效果类似。
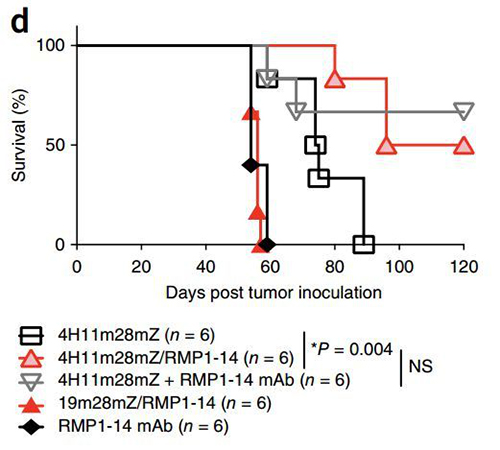
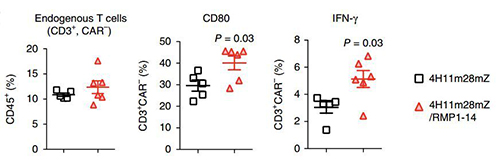
在肿瘤接种120天时,小鼠体内仍可检测到装甲CAR-T细胞。受到免疫检查点抑制剂鼓舞效果增强的不只装甲CAR-T,肿瘤微环境中的普通T细胞也受到鼓舞,表达的CD80、CD107α、IFN-γ、颗粒酶B等与抗肿瘤活性相关的细胞因子水平都上升。
在小鼠中获得初步成功后,研究者筛选了人源的PD-1抗体片段,锁定表现最稳定的E27片段,成功构建了人源的装甲CAR-T。人源装甲CAR-T表现与小鼠装甲CAR-T一致,可很好地结合并有效抑制PD-1,在与肿瘤细胞共培养过程中,表现出比普通CAR-T更好的增殖能力。
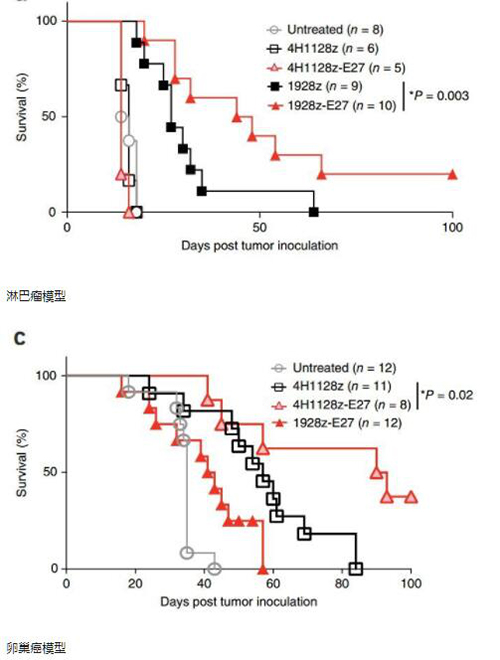
在淋巴瘤和卵巢癌小鼠模型中,人源化装甲CAR-T均表现出比普通CAR-T更好的疗效,小鼠存活期大大延长,装甲CAR-T比普通CAR-T联合PD-1抗体表现出更好的疗效。
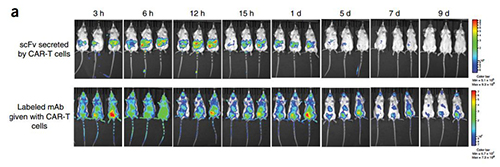
研究者检测了小鼠体内的PD-1抗体和scFv的去向,通过荧光成像看到PD-1抗体注射到小鼠体内后很快扩散至全身,而scFv因是CAR-T分泌,基本保持在肿瘤内,未在小鼠血液中检测到scFv,说明scFv较少或基本不进入血循环,意味着抑制免疫检查点带来的全身不良反应将大大减少。
该方法为CAR-T研究提供了新的思路,可建立分泌不同分子的CAR-T,根据患者需求量身打造。免疫检查点除了PD-1,还有CTLA-4、LAG-3、TIM-3等,这些都是未来可能被添加到CAR-T上的新装备。研究者正在设计临床试验,希望这些装甲CAR-T可以在肿瘤治疗中一展拳脚。
(编译 王微微)














