卢铀教授团队发布世界首个CRISPR基因编辑临床试验数据 研究证实CRISPR编辑T细胞治晚期肺癌安全可行
四川大学华西医院卢铀教授团队在顶级期刊《自然·医学》上发布最新研究成果,使用CRISPR-Cas9编辑的T细胞在临床上治疗疾病是安全可行的。该研究成果再次证实CRISPR基因编辑技术在临床应用中的安全性,为后续类似研究的开展奠定了基础。(Nat Med. 2020; 26: 732-740. doi: 10.1038/s41591-020-0840-5)

研究者发起的这项基因编辑临床研究,是世界第一个CRISPR疗法人体试验,开始于2016年6月。当时,大量的基础研究证实,CRISPR-Cas9是一种方便、灵活、精确的基因编辑方法,但CRISPR-Cas9在临床应用中的安全性还需临床研究检验。同时,癌症免疫疗法也在蓬勃发展。阻断PD-1/PD-L1通路的PD-1抑制剂,已成为PD-L1表达阳性的晚期NSCLC的一线治疗药物。免疫疗法能将患者的5年生存率提高到15.5%~23%。免疫疗法的成功,让研究者想到:破坏T细胞的PD-1,然后将T细胞回输给患者,对于晚期肺癌的治疗可能也是有效的。
这个设想一方面基于免疫治疗的基本逻辑,另一方面是基于当时的两项基础研究:用锌指编辑技术编辑T细胞的PD-1,可增强T细胞对黑色素瘤细胞的毒性;用CRISPR-Cas9破坏T细胞的PD-1,可在小鼠模型身上对抗胃癌。
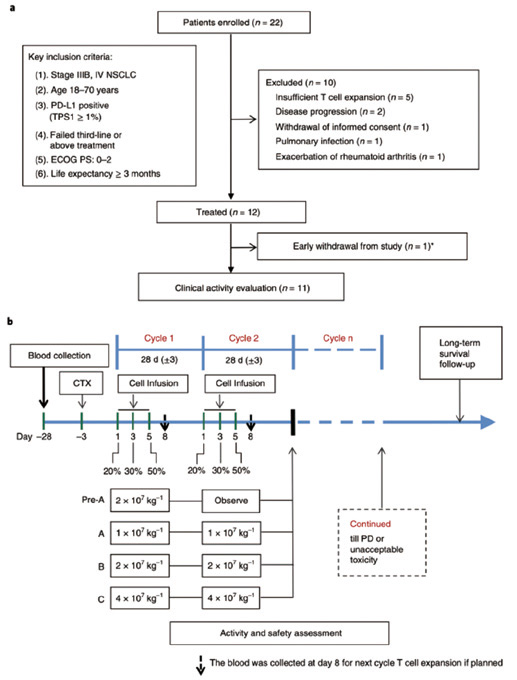
基于以上研究成果,卢铀教授团队在晚期肺癌患者中,开展了临床研究。由于是首个人体临床试验,考虑到伦理学问题和脱靶突变风险,在剂量递增的Ⅰ期临床试验中,只招募那些经过多种疗法治疗之后依然无效的NSCLC患者。
在2016年8月26日到2018年3月21日之间,共招募22例患者。研究者从患者体内采集T细胞,然后用电穿孔的方法将CRISPR-Cas9编辑系统转入T细胞中,破坏PD-1基因的2号外显子。总体看,基因编辑的效率在8.7%~31.2%,中值为20.1%。在编辑过的T细胞中,PD-1的表达水平明显降低,PD-1的破坏率在33.7%~67%,中值为46.3%。

在招募的22例患者中,有5例患者因T细胞体外扩增不足,未接受治疗,其余17例患者均获得了高活性(90%)的编辑后的T细胞。制备T细胞的中位时间是25天(17~40天)。在回输编辑过的T细胞之前,有2例疾病进展,1例肺部感染,1例类风湿关节炎加重,1例主动退出研究。最终有12例接受了T细胞回输治疗。
接受治疗的患者以28天为一个周期,分三次注射PD-1被编辑过的T细胞,直至患者疾病进展或出现不能耐受的毒性,每例患者每次回输T细胞的中位数为1.33亿个。
12例接受治疗的患者中,T细胞中位编辑效率是5.81%。在所有被编辑的T细胞中。绝大部分是CD3阳性(中值99.1%),CD3和CD8双阳性占比73.5%。与未被编辑的T细胞相比,在被编辑过的T细胞中,CD8和IFN-γ双阳性的占比显著增加。提示破坏T细胞的PD-1之后,T细胞的活性增强了。
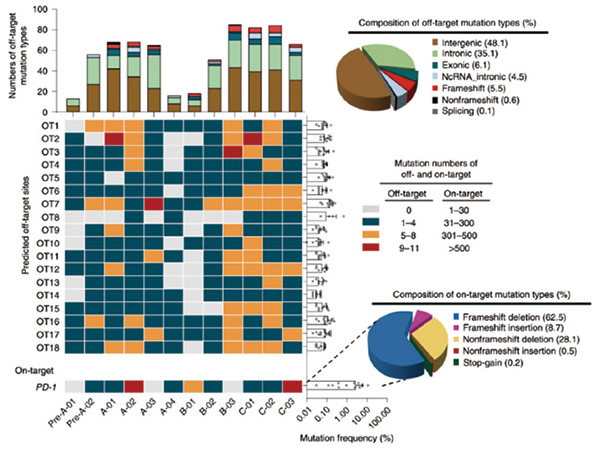
总体看,中位脱靶率是0.05%,远低于1.69%的中靶率。研究者认为,CRISPR-Cas9编辑T细胞是安全的。在主要的脱靶导致的突变中,会导致移码变异的插入/缺失占比71.2%,不会导致移码的插入/缺失占比28.6%,其他类型变异极少。这些突变主要出现在基因之间(48.1%)或者内含子(35.1%)区域,对基因功能的影响不大。
从安全性上来看,在12例接受治疗的患者中,有1例患者未出现治疗相关不良事件,其余11例患者发生了1/2级与治疗相关的不良事件,例如淋巴细胞减少症(3例)、疲劳(3例)、白细胞减少症(2例)、发烧(2例)、关节痛(2例)和皮疹(2例)。提示无患者出现3级及以上的不良事件,且无患者出现细胞因子释放综合征。也就是说,CRISPR破坏T细胞的PD-1,作为一种治疗策略是安全的。
从疗效上看,在长达47.1周的中位随访时间内,12例患者的中位无进展生存期(PFS)是7.7周,中位总生存期(OS)为42.6周。无患者获得部分缓解,只有两例患者病情稳定。截至2020年1月31日,所有患者出现疾病进展。在12例患者中,有11例(91.7%)死于肿瘤进展,所有患者的死亡均与治疗无关。剩下的一例患者仍在接受其他治疗。
研究者认为,该研究成果进一步支持了由CRISPR-Cas9技术进行的基因编辑T细胞疗法在临床上的安全性和可行性,这也与Carl June团队近期发表的结果一致。至于大家担心的脱靶效应,一是脱靶率低,二是绝大多数发生在非编码区,不太可能对编码基因产生重大影响。虽然CRISPR-Cas9技术的临床使用的长期安全性仍需证实,但在本研究中,被编辑的T细胞寿命较短,可认为永久性基因组改变的风险是有限的。
(编译 张华鑫)


