两研究证实IL-8或可作为免疫疗法标志物
免疫治疗改观了许多瘤种的治疗模式,但并非所有患者都能从免疫治疗中获益,需要寻找有效的生物标志物预测哪些患者对免疫治疗敏感。PD-L1和肿瘤突变负荷已有一些研究探讨,但至今尚无效果好方便检测的标志物。
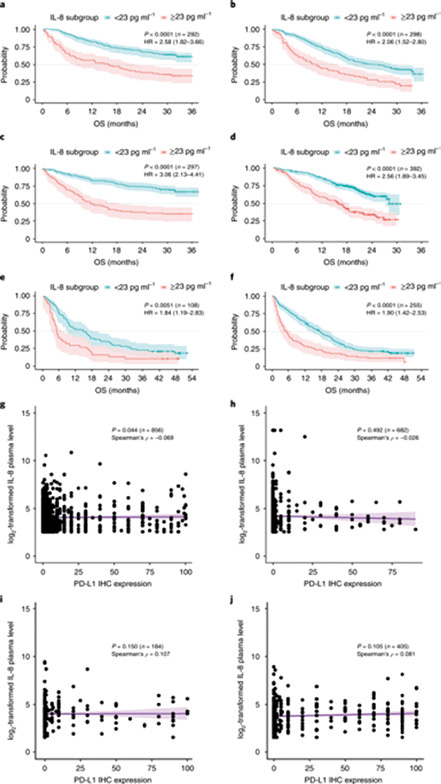
《自然·医学》杂志刊发了两篇研究报告,共同锁定了一种新的疗效预测标志物,血浆白介素-8(IL-8)水平,两项研究分别回顾性分析了PD-1抑制剂和PD-L1抑制剂的两项临床试验数据近3000例患者,发现基线IL-8水平与预后不良显著相关。高IL-8水平与更高的肿瘤嗜中性粒细胞/单核细胞浸润、更差的T细胞功能、更弱的抗原递呈有关。IL-8水平可作为免疫治疗受益人群的标志物,以高IL-8表达作为靶点,开发新的治疗方法,或可克服免疫检查点抑制剂耐药。(Nat Med. 2020; 26: 688-692. doi: 10.1038/s41591-020-0856-x Nat Med. 2020; 26: 693-698. doi: 10.1038/s41591-020-0860-1.)
IL-8是一种细胞因子,有CXCR1和CXCR2两个受体。IL-8由单核细胞、内皮细胞和各种上皮细胞产生,参与感染反应、炎症反应和癌症发生。IL-8可招募嗜中性粒细胞,刺激血管生成和肿瘤细胞的增殖;此前研究也有发现,较高的IL-8水平与肿瘤分级/分期更晚、肿瘤负荷更高有关。但IL-8与免疫疗法预后的关系尚未在大样本临床试验中得到验证。

研究一
第一项研究旨在探讨IL-8与PD-1抑制剂单药和与CTLA-4抑制剂联合治疗的疗效关系,共纳入4项Ⅲ期临床试验:CheckMate 067(黑色素瘤)、CheckMate 017(鳞状非小细胞肺癌)、CheckMate 057(非鳞状非小细胞肺癌)和CheckMate 025(肾细胞癌),分析了1344例患者的血浆IL-8水平。

分析发现,27.1%~34.3%的患者基线血浆IL-8水平≥23 pg/ml,这部分患者明显总生存期更短。CheckMate 067研究中采用PD-1+CTLA-4双免疫联合治疗黑色素瘤患者,高IL-8与低IL-8水平患者之间的生存风险比超过3倍。IL-8与预后的负相关不仅限于双免疫治疗,免疫治疗单药、双药、与mTOR抑制剂依维莫司联用或与化疗多西他赛联用,均显示了这一相关性。IL-8水平和PD-L1表达相关性很低,IL-8对生存的影响是独立的。
研究者分析了血浆IL-8水平、肿瘤关键免疫转录物质的表达以及循环免疫细胞群之间的关系。血浆IL-8水平与肿瘤中CXCL8基因表达、嗜中性粒细胞/单核细胞计数呈正相关。肿瘤中IL-8的水平则与肿瘤中IFN-γ、T细胞浸润相关转录负相关。提示IL-8存在对适应性免疫的抑制作用,影响抗原递呈和效应T细胞的抗肿瘤活性,肿瘤来源的IL-8还与免疫耐受髓样细胞浸润有关系。
研究二
第二项研究关注的则是PD-L1抑制剂,纳入了3项临床研究:IMvigor 210(转移性尿路上皮癌,Ⅱ期)、IMvigor 211(转移性尿路上皮癌,Ⅲ期)、IMmotion 150(转移性肾细胞癌,Ⅱ期)。研究者分析了所有1445例患者的血浆IL-8,还进一步评估了肿瘤及外周血单核细胞的RNA表达。
与第一项研究结果类似,IL-8水平较高与较差的预后有关。虽然在统计学上无显著差异,但血浆IL-8水平对免疫治疗单药组的影响似乎比联合用药组更加明显。
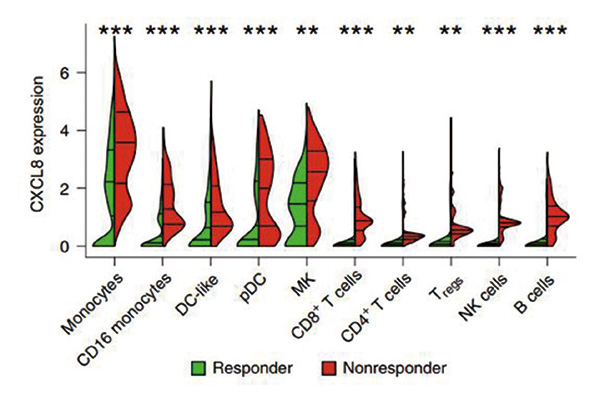
研究者进一步对5例免疫治疗应答患者和5例耐药患者的外周血单核细胞亚群进行了RNA测序。IL-8在髓细胞中表达更高,且与响应免疫治疗的患者相比,耐药患者体内产生IL-8的髓细胞和淋巴细胞比例更高,IL-8水平也更高。在IL-8高表达的髓细胞中,炎症基因表达更高,与抗原递呈相关的基因,比如人类白细胞抗原(HLA)和IFN-γ诱导基因都有所下调。
IL-8也存在对T细胞功能的抑制。在低IL-8水平的患者中,CD8+T细胞活化标志表达水平更高。提示高IL-8很可能导致对抗肿瘤免疫的抑制,而靶向IL-8或是破解免疫治疗耐药的方法。

两项研究显示,IL-8可能是免疫检查点抑制剂耐药的驱动因素。除了对直接执行抗肿瘤免疫的T细胞的影响之外,免疫抑制性髓细胞的浸润也是关键。免疫疗法预后标志物有了新发现,血浆IL-8水平是新的可靠的易检测的标志物,不过这还需前瞻性研究进一步证实。两项研究彰显了IL-8在免疫治疗中的重要作用,对IL-8作用的抑制,单用的抗肿瘤治疗效果或作为免疫治疗的辅助,值得探索,已有一些早期研究在进行中。
(编译 张华鑫)


