CRISPR技术发现182个潜在免疫疗法靶点
加拿大多伦多大学Lawson等,使用CRISPR筛选技术,系统性地寻找引发癌细胞逃脱免疫系统攻击的驱动基因。研究者发现,与自噬作用(autophagy)相关的多种基因是免疫逃逸的关键。(Nature. 2020年9月23日在线版. doi: 10.1038/s41586-020-2746-2)
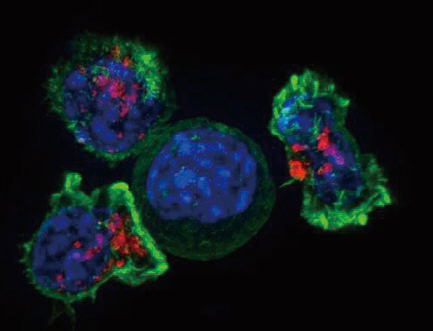
为了系统性地研究不同基因对癌细胞逃避免疫系统攻击的影响,研究者使用CRISPR-Cas9技术,构建了一个能敲除19069种编码蛋白的基因的向导RNA(gRNA)库。使用这一工具,挨个敲除了6种不同癌细胞系中编码蛋白的基因。这6种癌细胞系来自乳腺癌、结肠癌、肾癌和皮肤癌,代表遗传背景较广泛的癌症模型。
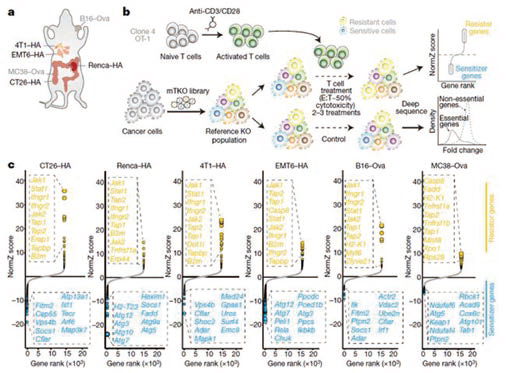
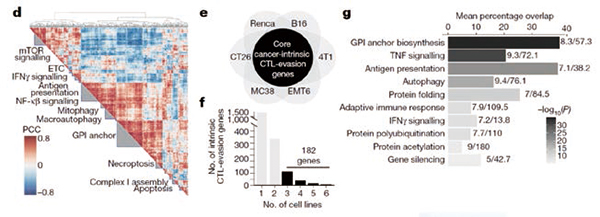
研究者把这些细胞系与已被激活的细胞毒性T细胞(CTL)放在一起,采用CRISPR技术对每个基因逐个关闭,观察哪些基因在敲除之后会让癌细胞对CTL更为敏感,哪些基因在敲除之后让癌细胞能够对CTL的攻击产生抗性。通过筛查发现了182个基因,这些基因在3种以上的细胞系中表现出相同的能力,能让癌细胞对CTL的杀伤作用更为敏感或更具有抗性。所有抗性的基因都在免疫应答无效患者中有突变,这些基因中许多之前并未发现与免疫逃逸有关。研究者将这些基因称为“核心癌症固有免疫逃逸基因”。研究者指出,不能停留在发现在一种肿瘤模型中可调节免疫逃逸的基因,发现那些在多种肿瘤模型中均可调节的基因更重要,这些基因可能成为最好的治疗靶点。
通过对6种不同癌细胞系进行CRISPR敲除筛选发现182个基因。
研究者通过对这182个基因的特征进行分析发现,它们中很多与调节干扰素γ(IFNγ)的信号通路相关。干扰素γ是在多种免疫应答中起到重要作用的细胞因子。进一步分析发现,与细胞自噬作用相关的多个基因,在调节干扰素γ信号通路中起关键性作用,其中有些基因此前并没未被发现与干扰素γ相关。研究者发现一个名为FITM2的基因,在小鼠脂肪组织的脂肪存储方面起关键性作用。若在细胞中敲除FITM2基因,它让三种癌细胞系对CTL更为敏感。
自噬作用好像细胞内的“废物回收站”,通过回收自噬过程中产生的氨基酸,细胞可以为合成新蛋白和构建细胞器提供原料。阐明自噬作用的研究在2016年获得了诺贝尔生理学或医学奖。在之前的研究中,研究者已经发现,抑制自噬作用的药物与其他抗肿瘤药物联用,可能产生更好的抗肿瘤疗效。例如,多个研究团队发现自噬抑制剂与MAPK信号通路抑制剂联用,可以抑制不同类型肿瘤的生长。
而在这项研究中,研究者发现一种名为autophinib的自噬抑制剂,能让多种肿瘤细胞系对另一种在细胞免疫应答中具有重要作用的细胞因子TNFα更为敏感,显示了抑制自噬作用可能在提高免疫疗法疗效方面的潜力。
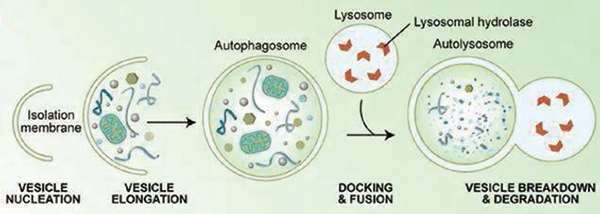
研究者指出,不同基因之间的相互作用对肿瘤细胞的免疫逃逸可产生很大影响。在研究与自噬作用相关的基因之间的相互作用时发现,敲除名为ATG12的基因时,会导致肿瘤细胞对细胞毒性淋巴细胞更为敏感,在敲除ATG12的同时敲除ATG5或ATG16L1,反而会让肿瘤细胞对细胞毒性淋巴细胞产生抗性。提示肿瘤已经携带的某些基因突变,可能决定特定靶向药物是会起到抑制癌症进展还是相反的效果。该研究中发现的介导肿瘤逃避细胞毒性T细胞作用的核心基因和信号通路,可能为指导开发新的癌症免疫疗法提供参考。
(编译 张嘉佳)


