特瑞普利单抗鼻咽癌新适应证获批
近日,君实生物宣布,其自主研发的抗PD-1单抗药物特瑞普利单抗注射液(拓益)联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗的新适应证获得国家药品监督管理局批准。这是特瑞普利单抗的第四项适应证在中国获批,也是特瑞普利单抗在鼻咽癌领域取得的第二项适应证。
特瑞普利单抗是中国首个批准上市的以PD-1为靶点的国产单抗药物。2018年12月17日,特瑞普利单抗获得国家药监局有条件批准上市,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗。
2020年12月,特瑞普利单抗注射液成功通过国家医保谈判,被纳入新版国家医保目录。2021年2月,特瑞普利单抗用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗获得国家药监局附条件批准。2021年4月,特瑞普利单抗用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗获得国家药监局附条件批准。
鼻咽癌是一种原发于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部肿瘤之一。据统计,2020年全球鼻咽癌新发病例数超过13万,其中近半数病例在中国。中国南方(如广东、广西)和东南亚地区高发。对于复发或转移性鼻咽癌,目前的治疗手段有限,一线标准治疗方案是以铂类为基础的两药联合化疗,但治疗后患者中位无进展生存时间仅有7个月左右。
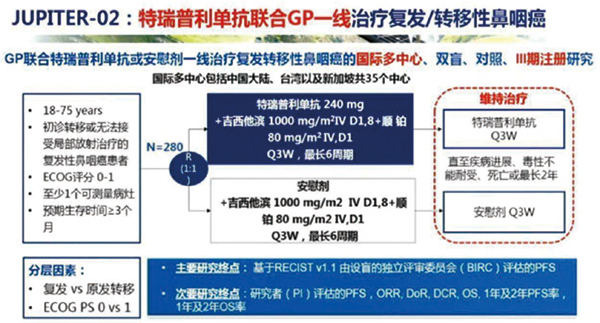
此次新适应证的获批基于JUPITER-02研究(NCT03581786),是一项随机、双盲、 安慰剂对照、国际多中心Ⅲ期临床研究,由中山大学附属肿瘤医院徐瑞华教授担任主要研究者。研究结果表明,特瑞普利单抗联合化疗组的中位PFS达11.7个月,比安慰剂联合化疗组延长3.7个月(HR=0.52,95%CI 0.36~
0.74,双侧P=0.0003);将近一半患者超过一年还没有发生疾病进展,比安慰剂组多21.5%,代表有更多患者获益;ORR为77.4% vs 66.4%,中位DoR为10.0 vs 5.7个月,比安慰剂组延长近1倍;目前总生存(OS)数据未成熟,不过已观察到特瑞普利单抗组总生存获益趋势,死亡风险降低40%。
作为迄今为止全球范围内规模最大的免疫检查点抑制剂联合化疗一线治疗复发或转移性鼻咽癌的Ⅲ期临床研究,JUPITER-02研究曾以“重磅研究摘要”形式入选美国临床肿瘤学会(ASCO 2021)年会全体大会,并在2021年9月以封面推荐形式刊登于《自然·医学》杂志(Nature Medicine)。
截至目前,除了在中国获批上市和开展临床,特瑞普利单抗在美国食品药品监督管理局(FDA)的首个生物制品许可申请(BLA)已获正式受理并被授予优先审评,特瑞普利单抗也是首个向FDA提交BLA的国产抗PD-1单抗。截至公告日,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌领域获得FDA授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和4项孤儿药资格认定。 (编撰 胡颖)


