研究发现染色体不稳定促进肿瘤转移机制
美国纪念斯隆·凯特琳癌症中心Bakhoum等研究发现,肿瘤细胞里,染色体不稳定性引起cGAS-STING通路长期激活,会导致细胞对炎症反应脱敏、信号通路重新布局,从而将肿瘤微环境构建成免疫抑制性,有助于肿瘤细胞转移。(Nature.?2023; 620:1080-1088.)
正常情况细胞质里不存在DNA,若染色体错误分离引起DNA碎片泄露到细胞质中,细胞会误以为有病原体入侵,激活cGAS-STING通路介导的炎症反应,表达干扰素启动细胞自发的抗病毒或抗肿瘤免疫应答,或招募T细胞来消灭异常细胞,有助于抑制致癌转化的发生。
此前研究者团队开展的研究发现,对于染色体错误分离和非整倍体发生频率很高的肿瘤细胞来说,STING通路的持续激活不仅不会导致其死亡,反而是在帮助肿瘤细胞转移。染色体不稳定性由细胞在有丝分裂过程中染色体分离持续出现错误所引起,多种类型肿瘤中普遍存在,被认为与肿瘤转移、免疫逃避和治疗耐药等相关。

研究者利用三阴性乳腺癌(4T1、EO771.LMB)、结直肠腺癌(CT26)、黑色素瘤 (B16F10)三种荷瘤小鼠模型验证,染色体不稳定性能促进肿瘤转移,并激活肿瘤细胞中的cGAS-STING通路。
通过构建不同免疫功能的荷瘤小鼠模型对比发现,在免疫功能正常的小鼠中,染色体不稳定性水平不同的肿瘤转移能力显著不同,在免疫功能严重受损的小鼠中差异较小,提示染色体不稳定性驱动肿瘤转移依赖于免疫系统。
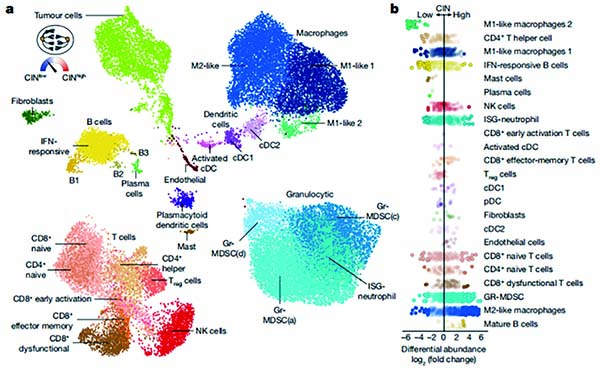
单细胞RNA测序结果显示,CIN水平高的肿瘤里富集巨噬细胞、功能失调T细胞等,构成免疫抑制肿瘤微环境;反之则富集免疫激活细胞。若抑制肿瘤细胞表达STING蛋白,可减轻CIN对肿瘤微环境的影响,使其更接近CIN水平低的状态。
研究者开发了名为ContactTracing的方法来探讨染色体不稳定性如何重新编程肿瘤微环境,基于单细胞RNA测序数据,ContactTracing能对细胞的特征进行分析,猜测细胞之间是如何互动的,帮助揭秘细胞间互相作用的方式。借助ContactTracing,研究者揭示不同CIN水平的肿瘤细胞内信号传导情况,以及对肿瘤微环境中其他细胞的调控方式。高水平CIN引发的肿瘤细胞内cGAS-STING通路长期激活,会导致细胞内信号传导发生改变。
内质网应激信号通路被启动,导致肿瘤细胞分泌免疫抑制和转移相关的细胞因子,如CCL2、CXCL1、IL11等细胞因子,作用于免疫细胞后重塑肿瘤微环境。干扰素刺激基因(ISG)表达显著下调,导致肿瘤细胞无法产生Ⅰ型干扰素(IFN-1)和响应其介导的免疫应答反应。
在人胚肺成纤维细胞的体外培养实验中,研究者使用STING激动剂(cGAMP)连续每日处理细胞,观察到与肿瘤细胞相似的结果。研究者发现,细胞很快对STING通路介导的炎症反应不再敏感,处理到第五天时基本就没有免疫反应了。
体外实验和小鼠实验结果显示,STING抑制剂(C-176,H151)能减轻高水平CIN肿瘤细胞中的内质网应激反应以及CCL2分泌水平,显著延长肿瘤小鼠的存活时间,减少肺部转移病灶。与对照组相比,小鼠接受STING抑制剂治疗耐受性良好,未观察到临床毒性,显示了STING抑制剂的治疗潜力。
这项研究成果为具有染色体不稳定性的癌症患者提供了新的治疗策略。在染色体不稳定性导致STING通路持续激活的情况下,一些患者的肿瘤细胞似已对STING通路介导的炎症反应不再敏感,再依靠STING的力量来抗肿瘤显然不是明智的策略,这些患者可从STING抑制剂中获益。(编译 吴静)


