国人肠菌增强免疫治疗疗效机制研究
浙江大学医学院附属第二医院王良静教授团队和附属邵逸夫医院陈淑洁主任医师团队合作,利用多组学测序和生物信息分析发现,共生约氏乳酸杆菌和生孢梭菌合作代谢色氨酸,产生的衍生物吲哚丙酸(IPA)可调控前体耗竭T细胞(Tpex),促进效应细胞分化,增敏免疫治疗,提升免疫治疗效果。补充IPA能显著提升抗PD-1单抗的抗肿瘤效果(Cell. 2024年3月11日在线版)
研究者还在结直肠癌、乳腺癌、黑色素瘤等多种小鼠肿瘤模型和肿瘤患者来源的类器官上进行了验证,有望为基于微生态的免疫治疗辅助方案提供新策略。
已有诸多研究发现,肠道菌群是影响免疫检查点抑制剂疗效的重要环境因素。不同肿瘤患者的肠道菌群组成不同,粪菌移植(FMT)已被证实能改善免疫检查点抑制剂反应性。尽管越来越多研究揭示了特定菌株可影响免疫检查点抑制剂疗效,但具体起效成分和内在机制仍有待阐明。
肿瘤微环境中浸润T细胞在免疫检查点抑制剂治疗中发挥关键作用。有研究表明,高表达转录因子T细胞因子1(TCF-1,由TCF7编码)、具有免疫干性特征的耗竭前体CD8+ T细胞(Tpex)是响应抗PD-1单抗免疫治疗的关键亚群。TCF7敲除鼠会伴随肠道菌群失衡,但特定菌株及其代谢物能否调节免疫细胞干性增敏免疫治疗还尚无报道。
研究者发现,小鼠中存在着和临床实践类似的免疫治疗“反应”鼠和“反应差”鼠,基于粪菌移植验证了肠道菌群可影响肿瘤免疫治疗疗效。通过粪便菌群测序、筛选,研究者分离了一株在“反应”鼠和“反应差”鼠之间丰度差异明显的约氏乳酸杆菌(L. johnsonii)。灌胃约氏乳酸杆菌可增加CD8+ T细胞浸润,增敏抗PD-1单抗疗效。
研究者探讨了约氏乳酸杆菌增强肿瘤免疫疗效的起效成分,发现菌源性代谢物可能发挥关键作用。利用非靶向代谢质谱,研究者锁定了色氨酸代谢通路,并结合色氨酸缺乏饮食、高效液相色谱串联质谱联用技术确定了起效的关键成分:吲哚丙酸。
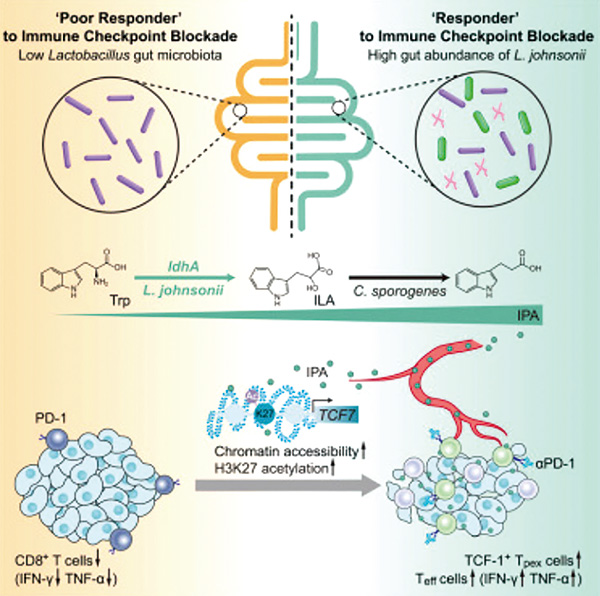
研究者进一步揭示了吲哚丙酸增强免疫疗效的机制。实验表明,约氏乳酸杆菌及其衍生的吲哚丙酸依赖CD8+ T细胞发挥增敏免疫治疗的作用,对小鼠灌胃吲哚丙酸后,“干细胞样”衰竭前体CD8+ T细胞(Tpex)和效应CD8+ T细胞的比例显著增加。进一步的测序发现,吲哚丙酸可增强TCF7 超级增强子区域的 H3K27 乙酰化,以此调控“干细胞样”TCF-1+ Tpex 细胞,促进效应细胞分化,从而增敏免疫治疗。
研究者在体外约氏乳酸杆菌培养上清液中无法检测到吲哚丙酸产生,反而检测到吲哚丙酸的上游代谢物吲哚乳酸(ILA)。基于抗生素鸡尾酒模型和腹腔注射模型,研究者猜想约氏乳酸杆菌产生的吲哚乳酸在体内被其他肠道菌群进一步代谢为吲哚丙酸来发挥作用。
研究者在无菌鼠模型中验证了这一猜想。单独定植约氏乳酸杆菌只能产生大量的吲哚乳酸;而与另一种梭菌属成员生孢梭菌(C. sporogenes)联合定植,无菌鼠可大量产生吲哚丙酸,增敏免疫治疗疗效。作者预测约氏乳酸杆菌产生吲哚乳酸的关键酶ldhA,并在大肠杆菌中进行异源表达证实了这一猜想:过表达ldhA酶的大肠杆菌可以增加吲哚丙酸产生,增敏小鼠免疫治疗。
研究者在多种小鼠肿瘤模型(乳腺癌皮下瘤模型、 乳腺脂肪垫原位癌模型、MMTV-PyMT自发瘤模型、黑色素瘤皮下移植模型、盲肠袋原位癌模型)和结直肠癌患者来源的类器官上验证了吲哚丙酸对Tpex细胞和免疫治疗的调控作用。
该研究揭示了一种由不同细菌合作产生的色氨酸衍生物,阐明了吲哚丙酸通过组蛋白乙酰化修饰调控免疫干性关键转录因子的机制,并在泛癌水平验证了吲哚丙酸增敏免疫治疗的作用。这条菌源性代谢物-宿主免疫调节途径为增敏免疫治疗提供了潜在的新思路。 (编译 黄欣)


