ER+、HER2-晚期或转移性乳腺癌 FDA批准Elacestrant治疗ESR1突变患者
美国食品与药物管理局(FDA)的Shah等报告,Elacestrant在激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)、晚期或转移性乳腺癌中的批准仅限于雌激素受体1(ESR1)突变(ESR1-mut)患者。ESR1-mut亚组的获益—风险评估是有利的,因为在可接受的安全背景下,无进展生存期(PFS)有显著的统计学意义上的改善,包括没有证据表明对总生存(OS)有潜在损害。相比之下,没有ESR1-mut患者的获益—风险评估并不有利。Elacestrant是首个获得FDA批准用于ESR1-mut患者的口服雌激素受体拮抗剂。(J Clin Oncol. 2024年2月21日在线版)
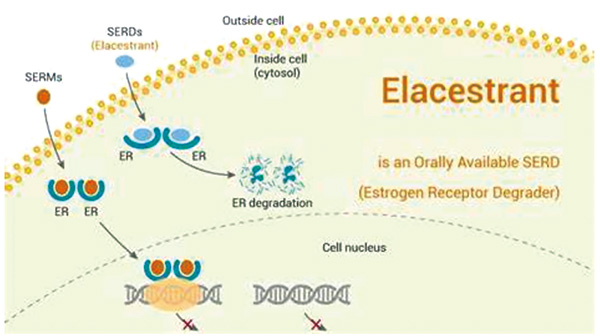
FDA批准Elacestrant用于治疗绝经后女性或成年男性,这些患者均为ER+、HER2-、ESR1-mut晚期或转移性乳腺癌,至少接受过一线内分泌治疗(ET)后疾病进展。
该批准基于EMERALD(研究RAD1901-308),这是一项随机、开放标签、阳性对照、多中心试验,在478例ER+、HER2-晚期或转移性乳腺癌患者中进行,其中包括228例ESR1-mut患者。患者被按照1∶1的比例随机分配接受Elacestrant(345 mg,每日一次口服;239例)或研究者选择的ET(239例)。
在ESR1-mut亚组中,通过盲法独立中心评价,EMERALD在PFS方面获得统计学上的显著改善(228例;HR=0.55,95%CI 0.39~0.77,P=0.0005)。虽然没有达到OS这一终点,但在ESR1-mut亚组中也没有潜在的OS受损的趋势(HR=0.90,95%CI 0.63~1.30)。意向治疗(ITT)人群的PFS也达到了统计学意义(ITT为478例;HR=0.70,95%CI 0.55~0.88,P=0.0018)。然而,ITT人群中PFS的改善主要归功于ESR1-mut亚组患者的结果。接受Elacestrant治疗的更多患者出现恶心、呕吐和血脂异常。
(编译 李小爽)


