研究发现将T细胞抗癌能力提高的策略
美国加州大学旧金山分校Garcia等报告,研究者大规模研究了T细胞淋巴瘤的潜在驱动基因变异,发现其中的一对基因的融合变异,竟可将T细胞抗实体肿瘤的能力提升百倍,且没有任何毒性迹象。貌似研究者发现了T细胞淋巴瘤的超能力,在将它移植给正常T细胞之后,正常T细胞就拥有了超级抗癌能力。(Nature. 2024, 626: 626-634.)
T细胞免疫疗法,虽彻底改变了血液系统肿瘤治疗范式,但在占成人癌症90%的实体瘤中表现差强人意,直到上个月FDA才批准了第一款治疗实体瘤的T细胞疗法lifileucel。
与血液系统肿瘤相比,实体瘤之所以难以突破,主要是因为受到多种因素的限制,例如T细胞在体内持久性差、实体瘤的肿瘤微环境存在强烈的免疫抑制,以及T细胞耗竭等等问题。简单来说,要想让T细胞搞定实体瘤,就得进一步提升T细胞的实力。
研究团队注意到,在预临床研究中提升T细胞抗癌效果的方法(PDCD1、TET2或DNMT3A失活),其实就是T细胞淋巴瘤中发现的突变。那既然如此,是不是可以从T细胞淋巴瘤找到解决上述问题的基因突变?
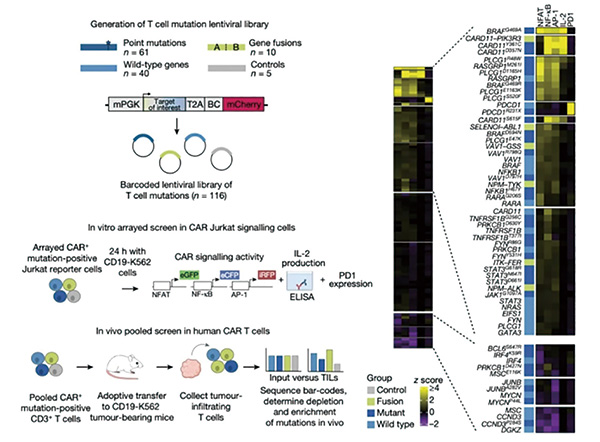
研究者选取了T细胞淋巴瘤的71个潜在驱动基因变异,包括分布在40个不同基因中的61个点突变,以及10个基因融合变异。然后在特殊的报告细胞系中研究不同的基因变异对T细胞功能的影响。经过层层筛选,最终选定CARD11和PIK3R3的融合。
与其他的变异相比,CARD11-PIK3R3融合能显著增强NF-κB和AP-1信号,以及IL-2的生成,而不增加NFAT或PD1。之前已有研究表明,NF-κB和AP-1信号的增强而不是NFAT信号的增强有助于对抗T细胞功能障碍;能产生高水平IL-2的CD8阳性T细胞亚群能更好地维持记忆表型和效应功能。在CD4阳性皮肤T细胞淋巴瘤患者身上发现的CARD11-PIK3R3融合值得进行进一步研究。
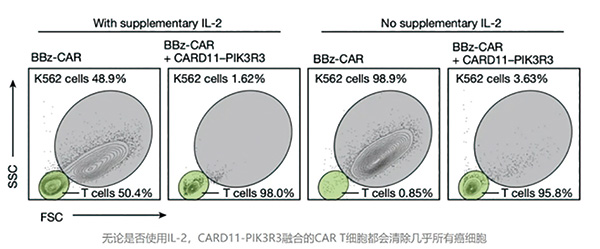
研究团队在两种不同的CAR T细胞中检验了CARD11-PIK3R3融合对CAR T细胞抗癌活性的影响。研究者发现,补充IL-2与否会影响普通CAR T细胞的抗癌效果,而不影响CARD11-PIK3R3融合的CAR T细胞抗癌效果(无论是否使用IL-2,都会清除几乎所有癌细胞),上个月获批的全球首个实体瘤T细胞疗法就需同时使用IL-2。
在7×106个CAR T细胞的较高剂量下,研究团队发现,对照组的普通CAR T细胞只能控制住43%的肿瘤,而CARD11-PIK3R3融合的CAR T细胞的肿瘤控制率为100%。值得注意的是,不含CD19-CAR的CARD11-PIK3R3融合T细胞没有抗肿瘤作用,这表明CARD11-PIK3R3融合增强的抗肿瘤活性需要抗原刺激。这也意味着,CARD11-PIK3R3融合CAR T细胞没有自主增殖风险。
此外,即使在高剂量处理下,CARD11-PIK3R3融合T细胞也表现出了良好的安全性。即使在回输后的第418天,也没有致淋巴瘤的迹象。
虽然以上研究都是在血液肿瘤小鼠模型中开展的,但后续在间皮瘤、黑色素瘤和胃癌小鼠模型中,均发现CARD11-PIK3R3融合可增强T细胞(CAR T细胞或TCR T细胞)的抗肿瘤效果。
在黑色素瘤的研究中,研究者发现,即使CARD11-PIK3R3融合CAR T细胞的数量仅有普通CAR T细胞的百分之一,它也能控制住肿瘤,而普通CAR T却做不到。这意味着,CARD11-PIK3R3融合CAR T细胞的抗肿瘤活性提升了100倍以上。
尤其值得一提的是,研究者还发现,CARD11-PIK3R3融合CAR T细胞治疗甚至不需要清髓就能发挥良好的抗实体瘤效果。
要知道,清髓已被证明能显著改善CAR T细胞的移植和疗效,以及具有诱变性、并增加继发性恶性肿瘤的风险;而CARD11-PIK3R3融合CAR T细胞却不需要这一步。这一方面说明,它的疗效确实更强了,另一方面可以避免不良事件的发生。
研究者这波操作,让T细胞成功获得了百倍功力,使其具备了强大的抗实体瘤能力,还进一步降低了CAR T细胞治疗风险。研究团队已经组建了一家新公司Moonlight Bio,正在将这项新发现转化为抗癌新疗法。 (编译 张嘉佳)


