研究报告靶向共价放射性药物
北京大学化学与分子工程学院应用化学系刘志博教授等,基于现代共价药物分子工程,发展了一类新的药物形式,即靶向共价放射配体(CTR),并从分子、细胞、小鼠及患者层面验证了该平台技术的有效性,突破了成纤维细胞活化蛋白(FAP,为泛癌种靶点)靶向放射配体因肿瘤摄取、滞留不足导致疗效不佳的瓶颈。(Nature. 2024年5月22日在线版)
靶向放射性核素治疗(TRT)是一种变革性的治疗方式,可满足肿瘤患者对晚期转移病灶治疗的迫切临床需求,而转移导致了超90%的肿瘤相关死亡。TRT利用对肿瘤特异或相关抗原具有高亲和力、选择性的放射配体,将强效的β或α放射性核素递送至病灶,进行分子级别的精准放疗。它具有诊疗一体化(将治疗核素替换为正电子或单光子核素实现PET或SPECT成像),“交叉火力”效应(消灭周围未被靶向的癌细胞),及差异化细胞杀伤机制(直接损伤DNA)等特性。近年来,美国FDA批准放射性药物常规用于治疗神经内分泌瘤和前列腺癌转移患者。
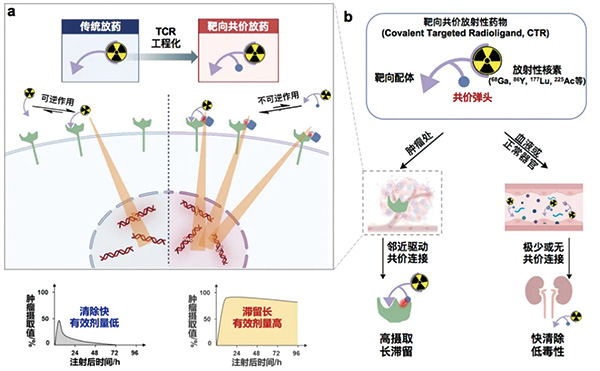
常用治疗放射性核素的半衰期可达3~10天。理想的治疗性放射配体需满足优异的肿瘤靶向、足够的肿瘤滞留和快速的正常器官清除。然而,如何平衡药物的血液清除和肿瘤滞留一直是药物设计中的经典难题。由于配体-靶点间常为可逆相互作用,传统低分子量放射配体的肿瘤滞留通常不足,大大制约了TRT的疗效。若能开发出一种平台技术,将放射配体以肿瘤选择性的方式不可逆地固定到癌症靶标上,将是解决上述问题的理想方案。
CTR可以是一个三功能配体,通过在适宜位置和取向上安装基于二代“点击化学”硫(Ⅵ)-氟交换反应(SuFEx)的“潜弹头”,实现配体在不损失亲和力的情况下对靶蛋白的共价连接,从而将携带核素的螯合剂不可逆地修饰到靶蛋白上。
当CTR到达肿瘤时,先非共价地结合靶标,后通过邻近效应加速不可逆的共价连接,在加强亲和力的同时将肿瘤清除率降至最低。而其他未结合靶标的自由CTR则被快速排出体内。得益于“潜弹头”的相对生物正交性,CTR的脱靶共价连接有限,因此其系统毒性可被有效控制。该研究首次报道了在人体中含SuFEx共价弹头分子的药代动力学研究,并验证了其在放射配体这一新兴药物形式上的匹配性。
对共价弹头的合理应用是CTR成功的关键因素之一。通过对FAP口袋残基的分析和共价对接,研究者在小鼠肿瘤模型中的初步研究发现:尽管在现有放射配体FAPI-04上安装磺酰氟弹头可提高肿瘤摄取,但存在由于弹头反应活性过高导致的稳定性问题。经弹头筛选,研究者采用放射自显影(Autoradioluminography)发现,安装的氟代硫酸酯弹头不仅可在试管中实现超过80%的FAP共价结合,且在6天内几乎没有解离。进一步,研究者通过二级质谱分析,发现所设计CTR-FAPI分子的共价连接残基位点主要为Y210和Y450,并通过分子动力学模拟验证了其共价结合构象的合理性和稳定性。
关于共价药物的一个普遍担忧是难以预知的脱靶毒性。由于放射配体普遍具有高亲水性且包含多电荷螯合剂,大多数放射配体对细胞膜的被动渗透性有限,因此CTR对胞内蛋白的脱靶作用可能不是问题。研究人员主要考察了CTR-FAPI对FAP同源膜蛋白的选择性,发现其仍能保持104倍的高度FAP选择性。此外,在小鼠血浆和患者尿液中,CTR-FAPI也显示出极低的脱靶反应性。
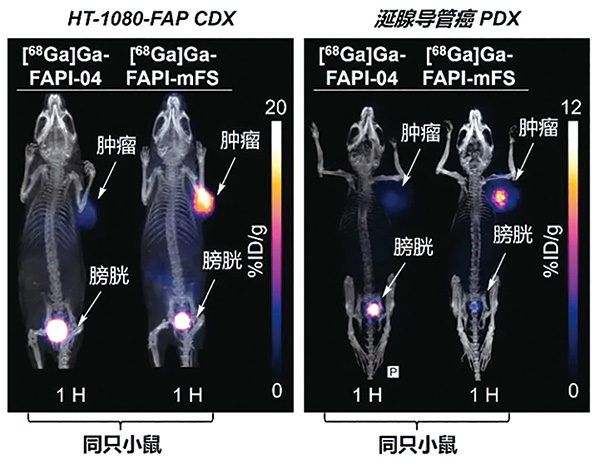
基于一系列分子实验和细胞验证,研究者分别在FAP高表达的细胞来源移植小鼠模型和患者来源移植小鼠模型中进一步验证,发现Ga-68(t1/2=67 min)标记的CTR-FAPI(即[68Ga]Ga-FAPI-mFS)显示比原始FAPI高2倍以上的肿瘤摄取,而健康组织中的摄取迅速清除。
在一项初步的肿瘤成像临床研究中,这一策略比其他方法(包括传统FAPI-PET/CT)识别出了更多的甲状腺髓样癌病灶,并通过手术和病理研究确认了这些病灶为真阳性。以上结果说明CTR-FAPI有潜力成为下一代更高灵敏度的FAPI-PET探针。
研究者进一步地采用长半衰期的Y-86(t1/2=14.7 h)正电子核素考察了CTR-FAPI的长时间药代动力学,发现肿瘤处摄取的积分下面积增加约10倍。基于Lu-177(t1/2=6.7 d)标记的CTR-FAPI剂量学估算同样说明肿瘤有效剂量提高了10倍左右。
研究者分别采用β-(Lu-177)和α-放射性核素(Ac-225, t1/2=9.9 d)标记CTR-FAPI,在后续治疗中几乎完全抑制了小鼠的FAP高表达皮下肿瘤生长。另一种靶向前列腺特异性膜抗原(PSMA)的SuFEx工程化放射配体也显示出更强的治疗效果。由于可连接SuFEx弹头的蛋白质较为广泛,这一策略或可用于靶向其他靶点的放射性药物,并为调控其他低分子量偶联类药物的药代动力学提供了新途径。 (编译 张嘉佳)














