研究揭示KRAS突变驱动分子特征
美国北卡罗莱纳大学Klomp等发表两篇背靠背论文,全面分析了KRAS突变驱动的分子特征,描述了KRAS突变是如何影响胰腺癌治疗效果的。(Science. 2024年6月7日在线版)
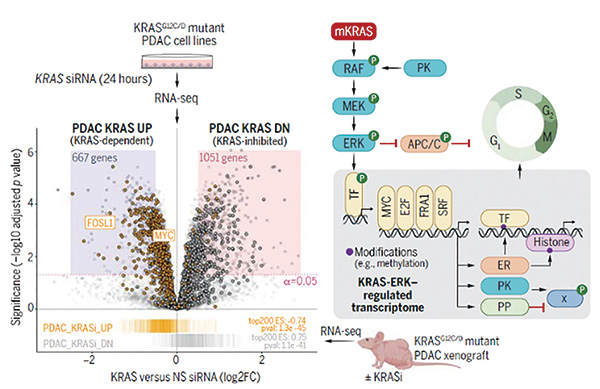
研究者首先在KRAS突变的胰腺导管腺癌(PDAC)模型中急性抑制KRAS,然后利用RNA测序来检测转录组变化,这种急性抑制可以限制KRAS缺失后的补偿信号,让最终结果更加准确。过往相关研究认为PI3K-AKT-mTORC1信号通路主导了KRAS突变驱动的胰腺癌生长,但新研究数据却带来了完全不同的角度,研究者发现RAF-MEK-ERK MAPK信号通路才是癌症发展的真正推动途径。研究显示,KRAS癌症驱动能力高度依赖于ERK蛋白,并且ERK蛋白的独立激活是导致KRAS抑制剂耐药性产生的关键因素。
研究者还发现KRAS突变驱动的癌症发展中,有约80%的蛋白表达变化是在转录水平受到调节的,另外还有一些调节发生在转录后,比如ERK蛋白的磷酸化。而ERK蛋白还能进一步影响数百种基因的表达量。作者表示,他们发现的KRAS-ERK的基因特征包括278个参与细胞周期基因的上调,这些信息可以用于预测癌症患者对KRAS抑制剂的反应程度。
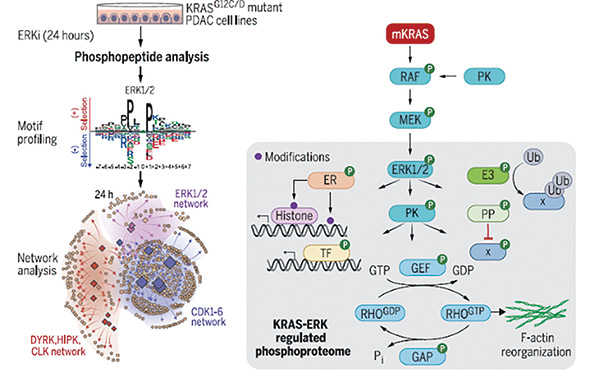
另一篇论文中,研究者揭示了KRAS突变驱动下的蛋白磷酸化特征,共鉴定出了2123个ERK依赖性的磷酸化蛋白,其中有67%在此前被认为与ERK无关。在此基础上,研究构建了一个基于ERK依赖性的磷酸化蛋白组的蛋白激酶信号网络,以此来展示随时间改变的激酶动态变化,包括周期蛋白依赖性激酶(CDK)等经典的激酶信号通路。
研究者尝试在癌细胞模型使用ERK抑制剂后,观察了磷酸化信号网络变化。他们发现在1小时后,主要丢失的是ERK依赖性以及RSK(ERK的直接底物)依赖性的磷酸化。到了24小时后,则主要丢失的是CDK依赖的磷酸化,同时也伴随着其他激酶的激活,这都体现出磷酸化信号网络的动态变化过程。
结合癌症依赖性图谱(DepMap)数据,研究发现ERK磷酸化蛋白组中有17%对PDAC生长非常关键,主要富集于细胞核定位蛋白以及细胞周期调节以及RHO GTP酶信号通路中。除此之外,癌基因MYC是支持KRAS突变癌细胞生长的驱动因素,同时也推动了KRAS抑制剂耐药性的产生。
这些信息极大地丰富了我们对KRAS突变、ERK信号通路的癌症病理学机制认识。也为研究KRAS抑制剂耐药性提供了数据基础,有望带来更有效的KRAS肿瘤治疗策略。期待未来能见证更多KRAS靶向疗法的诞生,让更多癌症患者受益。
KRAS是癌症中最常见的基因突变之一,同时也与肿瘤恶性发展具有密不可分的联系。以有“癌王”之称的胰腺癌为例,约90%的胰腺癌肿瘤中都能检测到KRAS突变,接受化疗的胰腺癌患者的诊断后生存期通常只有6~12个月。
过去相当长一段时间里,KRAS蛋白被认为是“不可成药”的,直到近年才出现了新转机。在围绕KRAS抑制剂的研发热潮中,迎来了首批获FDA批准的KRAS靶向疗法,包括Lumakras(sotorasib)和Krazati(adagrasib)等。
研究者指出,从已有数据看,KRAS靶向疗法仍具备改进空间,只有不到40%的胰腺癌患者会对KRAS抑制剂治疗产生反应,如果能建立KRAS相关的分子标志物图谱,或许能预测最可能受益于KRAS抑制剂治疗的患者。
(编译 张嘉佳)


