Ⅲ期AMEERA-5研究失败
美国洛杉矶加利福尼亚大学约翰逊综合癌症中心Bardia等报告,根据数据监测委员会在进行中期效用分析时提出的建议,AMEERA-5研究已停止。没有发现新的安全信号。(J Clin Oncol. 2024年6月18日在线版)
AMEERA-5研究了amcenestrant[口服选择性雌激素受体(ER)降解剂]联合帕博西尼对比来曲唑联合帕博西尼一线治疗ER阳性/人表皮生长因子受体2阴性(ER+/HER2-)晚期/转移性乳腺癌(aBC)的疗效。
在AMEERA-5这一双盲、双模拟、国际Ⅲ期试验中,未接受全身治疗的ER+/HER2- aBC绝经前/绝经后成年女性和男性按1∶1的比例被随机分配到amcenestrant(200 mg每日一次)+标准帕博西尼剂量(125 mg每日一次,21天,休7天)组,或来曲唑(2.5 mg每日一次)+标准帕博西尼剂量组,按新发转移性疾病、绝经后女性和内脏转移进行分层。主要终点是无进展生存期(PFS),使用单侧Ⅰ型错误率为2.5%的分层对数秩检验进行比较。次要终点包括总生存期(关键次要终点)、药代动力学和安全性。
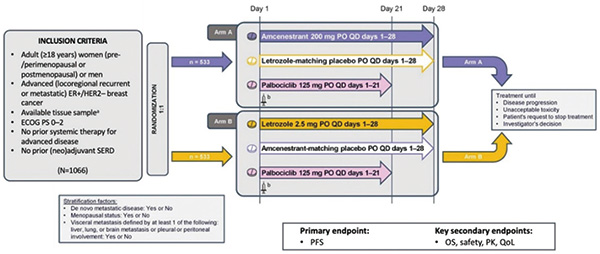
2020年10月14日至2021年12月2日,1068例患者被随机分配到amcenestrant +帕博西尼组(534例)或来曲唑+帕博西尼组(534例)。中期分析时(中位随访8.4个月),PFS的分层风险比为1.209(95%CI 0.939~1.557,P=0.9304);因此,该研究因无效而被终止。
amcenestrant+帕博西尼组的6个月PFS率为82.7%(95%CI 79.0%~85.8%),而来曲唑+帕博西尼组的为86.9%(95%CI 83.5%~89.6%)。amcenestrant+帕博西尼组对比来曲唑+帕博西尼组,治疗中出现的紧急不良事件(任何级别)发生率分别为85.6%和85.4%,≥3级事件的发生率分别为46.3%和60.8%。 (编译 倪凯乐)


