佐妥昔单抗治疗胃癌研究汇总分析
中山大学肿瘤防治中心徐瑞华教授等报告了一种新靶点药物Zolbetuximab联合化疗在局部晚期/转移性G/GEJ患者中的疗效与安全性的两项临床试验汇总分析结果。汇总分析显示,佐妥昔单抗(Zolbetuximab)联合化疗显著延长了HER2阴性CLDN18.2阳性晚期胃或胃食管结合部腺癌患者的无进展生存期和总生存期,将为这部分晚期胃癌患者一线治疗提供新的选择。(N Engl J Med. 2024年9月16日在线版)
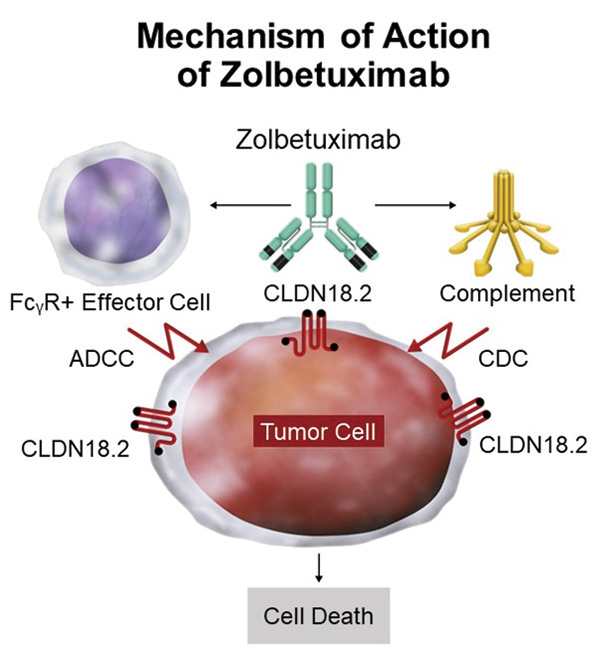
Zolbetuximab是一种针对claudin18.2的IgG1单克隆抗体。在两项Ⅲ期试验SPOTLIGHT1(NCT03504397)和 GLOW(NCT03653507)的无进展生存期(PFS)最终分析和OS中期分析中,Zolbetuximab联合一线化疗在人类表皮生长因子受体2 (HER2)阴性、局部晚期不可切除或转移性G/GEJ(claudin 18.2 阳性)患者中显著延长PFS和OS。研究者报告了OS率的最终分析结果以及两项试验的综合分析结果,以及对其他疗效和安全性终点的最新分析结果。
SPOTLIGHT和GLOW研究都是全球性、多中心、随机、双盲、安慰剂对照的Ⅲ期临床研究,共纳入了1072例CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃癌或胃食管结合部腺癌患者,患者随机接受佐妥昔单抗联合化疗或安慰剂联合化疗,其中SPOTLIGHT研究中的化疗方案是mFOLFOX6,GLOW研究中的化疗方案是CAPOX。主要研究终点为无进展生存期(PFS),关键次要研究终点是总生存期(OS),其他次要研究终点包括客观缓解率(ORR)、缓解持续时间(DoR)和安全性等。
共纳入1072例患者,被随机分配至Zolbetuximab组(537例患者)或安慰剂组(535例)。除黑种人数量较少外,全球各地患者的入组情况和基线特征具有代表性。
Zolbetuximab的PFS中位随访时间18.2个月(95%CI 15.4~20.9个月),安慰剂组的PFS中位随访时间为17.9个月(95%CI 14.8~23.7个月)。Zolbetuximab组的OS中位随访时间为32.7个月(95%CI 29.5~34.3个月),安慰剂组的OS中位随访时间为31.8个月(95%CI 29.7~34.3个月)。
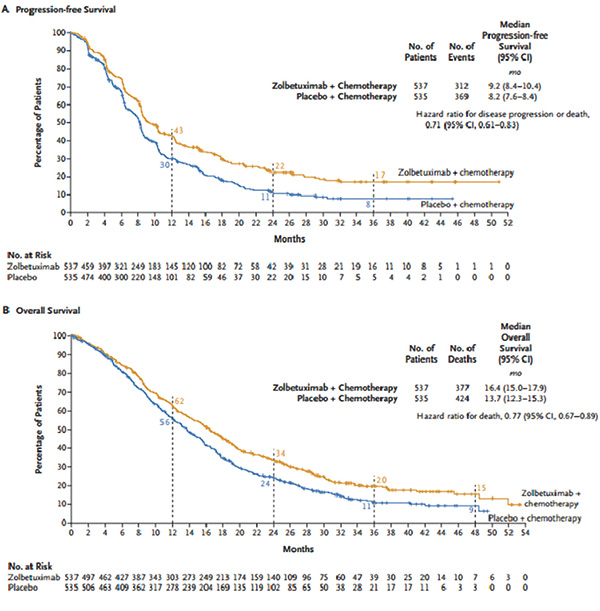
汇总分析显示,与安慰剂+化疗相比,佐妥昔单抗+化疗显著延长了无进展生存期,治疗组和安慰剂组的中位PFS分别为9.2个月和8.2个月,疾病进展风险降低了29%(HR=0.71,95%CI 0.61~0.83),达到了主要终点。Zolbetuximab组537例患者中有377例(70.2%)死亡,安慰剂组535例患者中有424例(79.3%)死亡。Zolbetuximab组的中位OS为16.4个月,安慰剂组的中位OS为13.7个月,死亡风险降低了23%(HR=0.77,95% CI 0.67~0.89),2年生存率治疗组是对照的2倍。各治疗组之间的后续抗癌疗法类型大致相同。
在HER2阴性、Claudin18.2阳性的不可切除的局部晚期或转移性G/GEJ患者中,Zolbetuximab联合化疗相比安慰剂联合化疗显著延长了PFS和OS。未观察到新的安全性信号。
在治疗期间,Zolbetuximab组治疗期间最常见的不良事件是恶心(Zolbetuximab组患者为发生率76.0%,安慰剂组患者发生率为56.2%)和呕吐(分别为66.8%和34.2%)。与早期数据的结果相比,未观察到新的安全性发现。两个治疗组的总体健康状况和生活质量评分相对于基线的平均变化趋势相似。
SPOTLIGHT和GLOW研究的汇总分析显示佐妥昔单抗联合化疗相比安慰剂联合化疗,显著延长了HER2阴性CLDN18.2阳性晚期胃癌患者的无进展生存期和总生存期,且未观察到新的安全性信号,给出了更强的循证医学证据。其中GLOW研究是由徐瑞华教授主导的国际多中心Ⅲ期临床研究,覆盖了中国、美国、欧洲、日本等多个国家和地区的160多个研究中心,中国以外的研究中心占75%。这两项研究的汇总分析将改变全球晚期胃癌的治疗格局,为CLDN18.2阳性的晚期胃癌患者提供新的治疗标准。
这两项研究的汇总分析将改变全球晚期胃癌的治疗格局,为CLDN18.2阳性的晚期胃癌患者提供新的治疗标准。基于这两项关键Ⅲ期临床研究中展现出的积极疗效,佐妥昔单抗联合化疗方案已经获得日本监管机构的批准,用于治疗CLDN18.2阳性、不可手术切除或晚期的胃癌患者,也已在我国、美国及欧洲等申报上市。
(编译 崔奕贝)


